通用血型转化的最新研究进展
中国输血协会临床输血管理学专业委员会组稿
空军军医大学第一附属医院输血组织编译
引言: 本期《输血医学新进展》聚焦于通用血型的转化研究,通过分享三篇发表在《Nature Microbiology》和《Nature Communications》杂志上的文章,展示了该领域的最新成果。研究者利用肠道共生菌Akkermansia muciniphila的糖苷酶成功制备出O型通用红细胞。MacMillan S等从粘蛋白降解菌(A. muciniphila)中发现了一种α-1,2-岩藻糖苷酶,该酶能够将通用O型血转化为稀有的孟买型血。此外,研究不仅在红细胞血型转化方面取得进展,在器官血型转化领域也实现了重要突破。肾移植是终末期肾病患者的最佳治疗方式,但血型不合(ABOi)会引发受者体内抗体介导的超急性排斥反应,导致移植物迅速破坏。研究者开发了将人类A型血肾脏通过酶法转化为通用O型血肾脏的技术,这一突破对扩大供体库、改善器官分配公平性具有重要意义。
01肠道共生菌Akkermansia muciniphila外切糖苷酶靶向A/B及其扩展血型抗原生成通用O型血液
1研究背景
血液是生命的源泉,全球血液资源紧缺。然而血液需求量巨大,每年需要进行超过1.18亿次献血,方能满足全球挽救生命的输血需求。另外,输血必须配型,因为供者红细胞和受者血型相合对于避免潜在的致命的输血反应至关重要。ABO血型系统是输血的主要免疫障碍,这是由于受体对供体RBC上的非自然ABO抗原的天然抗体之间的潜在的不相合反应。如果能够将其他血型都转化为相对“万能”的O型血,血液不足和偏型的情况就能够有所好转。早在1982年,有科学家提出了用酶修饰红细胞表面抗原,将A型和B型红细胞转化为O型红细胞的方案,尽管认为A/B抗原被完全转化,但仍观察到与供者血浆不相容的现象。后续研究发现,在A/B抗原上,还存在其他糖基团形成的扩展抗原延伸链,正是这些结构增加了酶切反应的复杂性,导致抗原实际上并没有被完全切除。直到今天,这个问题终于迎来了一次历史性的进步。丹麦技术大学研究团队提出了一项突破性技术,利用肠道共生菌Akkermansia muciniphila的糖苷酶组能够高效转化红细胞表面ABO血型系统中的A、B抗原及其扩展抗原,从而制造出ABO型通用血液。
2主要研究结果
本研究从Akkermansia muciniphila菌中克隆、表达并纯化筛选23种糖苷酶,通过色谱分析评估酶活性,开发了能够同时清除A、B抗原及其四种扩展结构的酶组合,显著提高了转化后红细胞与O型血浆的相容性。通过测试发现,AmGH110A在去除RBC上的B抗原方面显示出了较高的效率,并通过结构生物学分析揭示了两类B抗原转化酶的新型碳水化合物的三维结构。该项技术不仅解决了传统酶法在转化血液中因抗原残留导致的不相容性问题,还为临床输血与器官移植提供了潜在解决方案,凸显了肠道微生物资源在生物医学中巨大的应用价值。最后,本研究通过严格的体外酶法与凝胶卡交叉配血试验,验证了该技术的可行性和安全性,为未来临床输血的应用奠定了基础,有望解决血型不相容问题,实现安全输血。

图1 AKK 酶去除RBC上的B抗原及其扩展抗原
a-c:B抗原及其扩展抗原的糖基结构及B抗原及其扩展抗原在B型红细胞上的表达水平。d-f,经AmGH110A (0.5?μM)处理后,B型红细胞上的糖基结构变化及B抗原和扩展抗原水平的变化。g-i:经AmGH20A(0.2?μM)处理后,B型红细胞上的糖基结构变化及B抗原和扩展抗原水平的变化。j–l,经AmGH110A (0.2?μM)处理后,B型红细胞上的糖基结构变化及B抗原和扩展抗原水平的变化。m-o:经AmGH110A (0.5?μM)和AmGH20A(0.2?μM)混合液处理后,B型红细胞上的糖基结构变化及B抗原和扩展抗原水平的变化。总之,AmGH110A在去除RBC上的B抗原方面显示出了较高的效率。
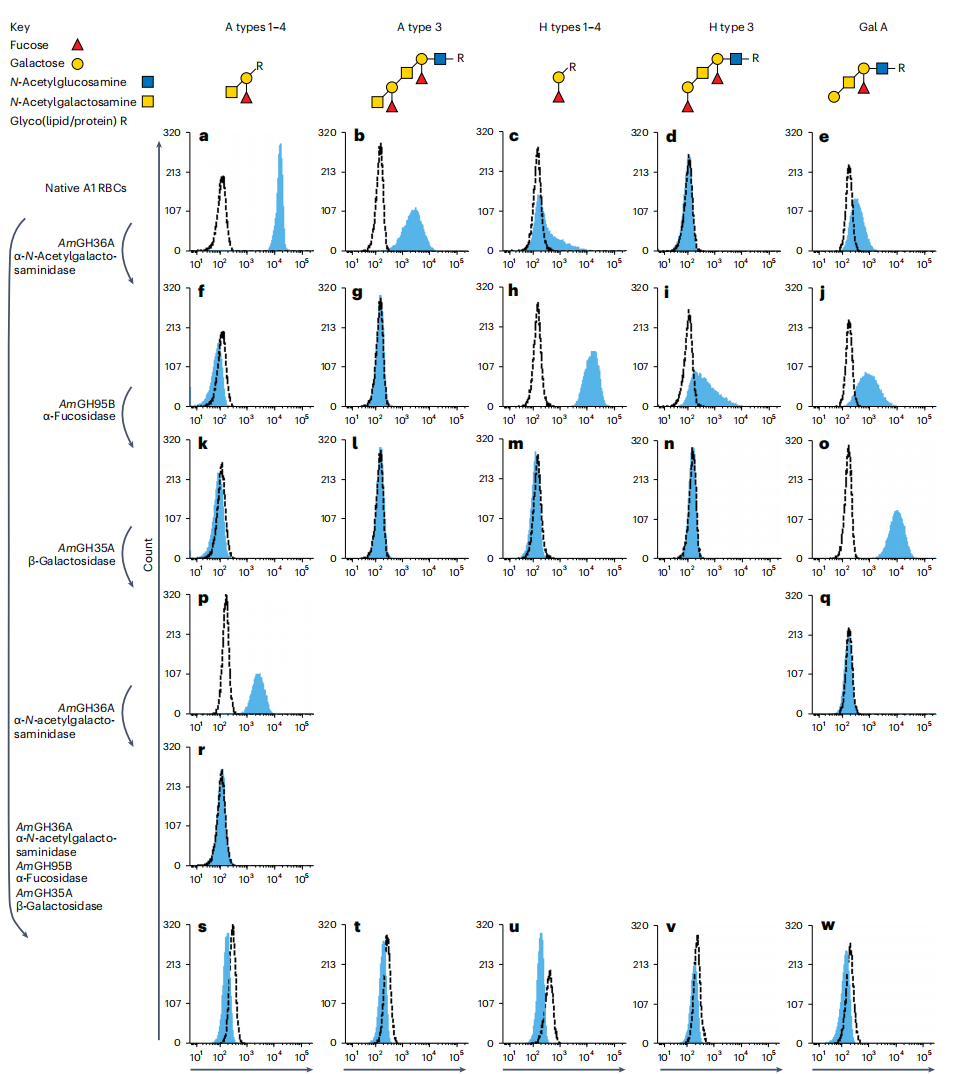
图2 AKK 酶去除RBC上的A抗原及其扩展抗原
图2结果表明,AmGH36A 酶在去除 RBC 上的 A 抗原及其扩展抗原方面表现出最高的效率。
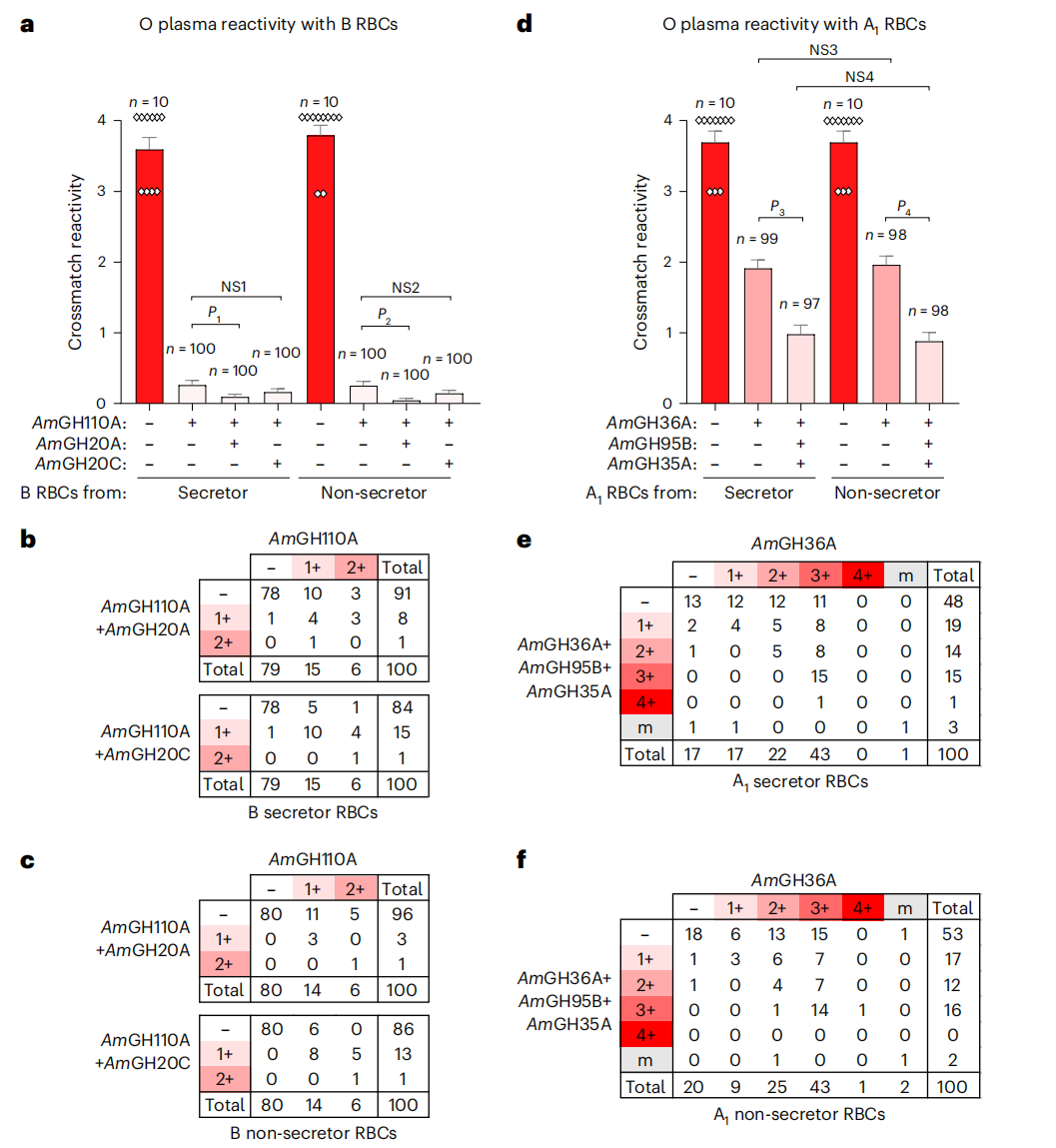
图3 与仅去除A和B抗原相比,去除A和B扩展抗原显著改善红细胞与O型血浆的相容
a. O型血浆与一个分泌者和一个非分泌者的红细胞的平均反应性。未经处理的红细胞与随机选取的O型血浆样本进行交叉配血作为基线反应性,与用AmGH110A (0.5?μM)或AmGH110A与AmGH20A或AmGH20C(两者均为0.4?μM)混合物处理30分钟后的反应性进行对比。b、c, O型血浆的反应性分布,以及不同处理方式与B型分泌红细胞(b)和非分泌红细胞之间的对比。d.未经处理的红细胞与随机选取的O型血浆样本进行了交叉配型,以展示与来自一位分泌者和一位非分泌者的A1型红细胞在不同条件下的基线反应性。这些反应性是在转化缓冲液中孵育30分钟后,分别与AmGH36A (1μM)单独处理或AmGH36A (1μM)、AmGH95B (20μM)和AmGH35A (0.2μM)的混合物进行比较。e,f,及不同处理方式下A1分泌型红细胞(e)与A1非分泌型红细胞反应性分布比较。结果表明,把AmGH110A和AmGH20A这两种酶混合起来,可以让B型血红细胞更容易与O型血浆匹配。扩展抗原是RBC与O型血浆相容性的关键。对于分泌型红细胞,交叉配型阴性的测试率从79%增加到91%,而非分泌型红细胞则从80%增加到96%,
3主要结论
本研究确定了一组高效转化酶,用于转化A、B抗原及其扩展抗原,还开发了酶最佳组合,用于A型和B型核心抗原的同时转化,显著提高了O型通用红细胞在交叉配血中的相容性。研究者也针对酶的结构进行了分析,找到了相应的活性基团,为后续针对性的结构改造提供了基础。同时,该研究为A型和B型扩展抗原的抗原性提供了有力的证据,A型和B型扩展抗原在输血相容性中起到了关键作用。另外,该技术将其他血型转换为通用O型血,有望增加血液供应,缓解血液短缺,填补了O型通用血液在输血和潜在器官移植中应用的空白。
4文献来源
Akkermansia muciniphila exoglycosidases target extended blood group antigens to generate ABO-universal blood. Nat Microbiol. 2024 May;9(5):1176-1188. doi: 10.1038/s41564-024-01663-4.
编译:刘二雄, 王文婷 审校:尹文
02 将通用O型血转化为罕见的孟买型血
1研究背景
1900年奥地利科学家Karl Landsteiner发现了人类首个红细胞血型系统——ABO血型系统,至今它仍是输血医学、法医和器官移植等领域中最重要的血型系统之一。ABO血型系统的抗原特异性和表现型由红细胞表面糖链的组成和连接方式决定,由此将血型抗原分为A、B、H和亚型。A、B和H抗原是由三个基因ABO、FUT1和FUT2编码的糖基转移酶的顺序作用形成的。血型抗原的合成始于共同的前体糖链(已知有六种不同类型)添加一个岩藻糖残基,获得H抗原。这个反应涉及两个岩藻糖转移酶。H等位基因编码一个α-1,2-岩藻糖转移酶(FUT1),它将岩藻糖残基转移到II型和IV型糖单元上,形成血管内皮细胞和红细胞上的H抗原。Se等位基因编码另一个α-1,2-岩藻糖转移酶(FUT2),它将岩藻糖残基转移到I型和III型糖单元上,形成胃肠道、呼吸道、唾液腺等分泌型H抗原。随后,A基因产生的α1,3--乙酰半乳糖胺转移酶,将N-乙酰半乳糖胺连接到H抗原半乳糖残基上,使之成为A抗原。B基因产生α1,3-半乳糖基转移酶,将D-半乳糖连接到H抗原半乳糖残基上,形成B抗原。O等位基因为无效基因,产生非活性转移酶,其只有H抗原,表现为O型血。孟买型由隐性纯合突变(hh)导致,个体缺失H基因和Se基因,无法产生α-1,2-岩藻糖转移酶,H抗原无法合成,进而也无法合成A、B抗原。孟买型个体血清中含有抗-A、抗-B和抗-H抗体,输血不能接受任何ABO血型的血液。否则,会引起严重输血反应,危及生命。因此,孟买型的受血者只能输注孟买型的血液,可是孟买血型属于罕见稀有血型,出现频率极低,临床上很难找到匹配血液,这为输血医学领域带来了极大挑战。本研究从粘蛋白降解菌(A. muciniphila)中发现了一种α-1,2-岩藻糖苷酶(命名为FucOB),其具有将通用O型血转化为稀有孟买型血的能力,并可作为一种生物技术和治疗工具,为孟买血型患者的输血问题及时有效的解决提供了参考方案。
2主要研究结果
本研究从粘蛋白降解菌(A. muciniphila)中发现了一种α-1,2-岩藻糖苷酶,将其命名为FucOB。结果表明,FucOB是对α-1,2-岩藻糖基化底物非常特异的酶,对α-1,3,α-1,4和α-1,6岩藻糖基化底物并没有活性。FucOB可以水解I型、II型和V型H抗原中的α-1,2岩藻糖残基,产生非岩藻糖修饰的孟买表型。但FucOB不能从V 型A抗原或V 型B抗原上切割α-1,2岩藻糖残基。对FucOB与H抗原结合界面进行了单点丙氨酸突变,结果发现接触岩藻糖残基的FucOB环(第25、35、37和39环)及位于α螺旋8中的N387A位点对于II型和V型H抗原的识别至关重要。W453A位点通过堆积作用稳定糖环在FucOB底物结合中起着重要作用。高分辨率X射线晶体结构分析显示FucOB为一个包括GH95糖苷酶的三域结构,通过详细的结构分析、分子对接计算、分子动力学模拟、广泛的定向突变和酶活性测定,揭示了FucOB催化和特异识别底物机制的分子基础。此外,通过血型凝集试验、形态学试验以及流式细胞术,再次证明了FucOB对H抗原中存在的L-岩藻糖的切割作用,能够将通用的O型血转化为罕见的孟买型血,转化后的孟买红细胞膜的活力和完整性均保持完好。从而为孟买型患者的输血提供了新的解决方案。
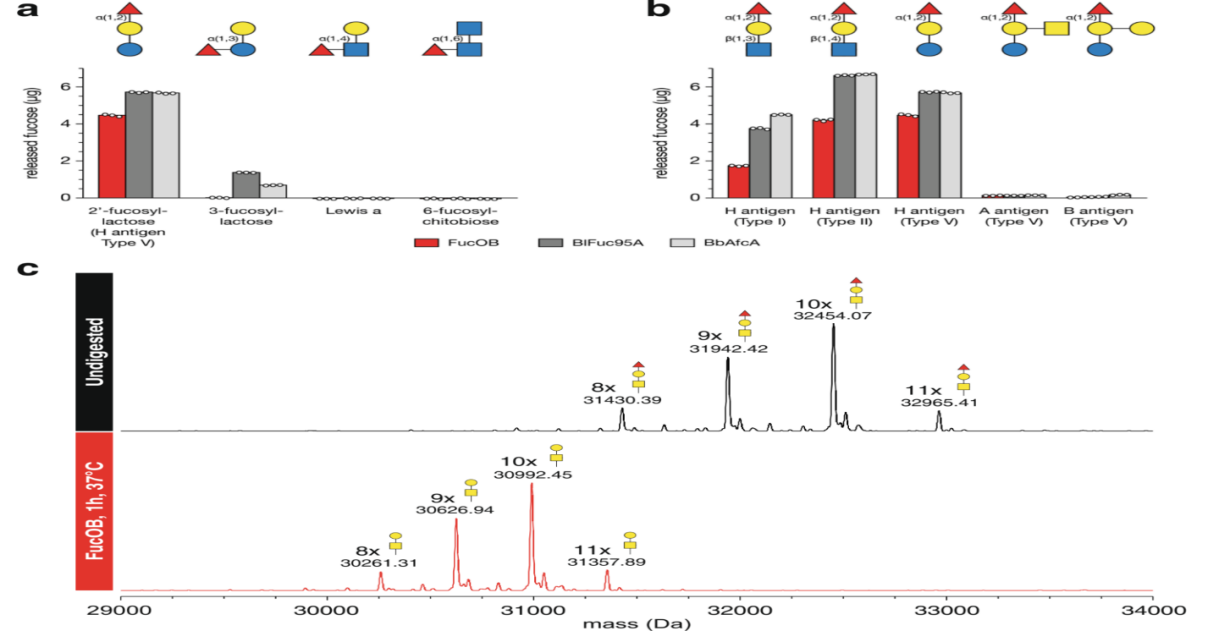
图1 FucOB的底物特异性
a.b将合成低聚糖与FucOB及其家族同源物BiFuc95A和BbAfcA在37℃下孵育30分钟,用分光光度法定量游离岩藻糖水平。c.FucOB不仅在合成寡糖中具有水解岩藻糖的能力,而且在更大的糖结合物中仍具有水解岩藻糖的能力。
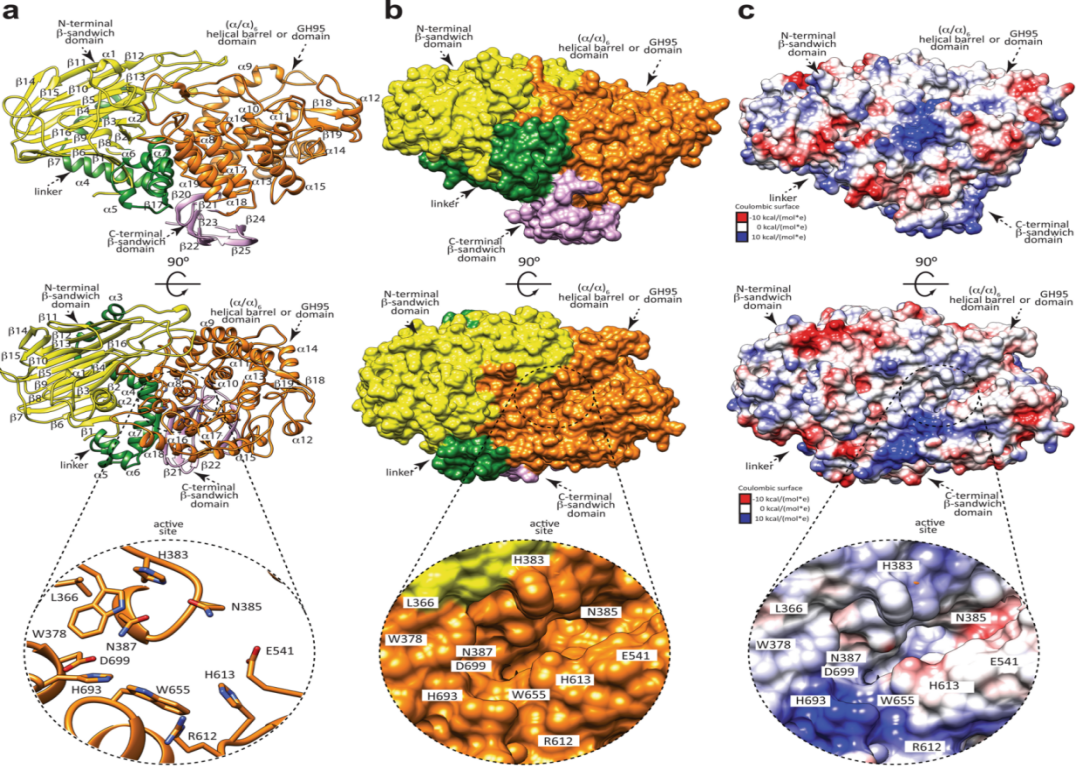
图2 FucOB的整体结构
a. FucOB的一般折叠和二级结构,包括GH95催化结构域以及N-和C-末端β-三明治结构域。底部圆图是活性位点的放大视图。b. FucOB表面表征。底部圆图展示了底物结合口袋。c .FucOB的静电势能面图,显示了底物结合位点和催化位点位置。底部圆图显示了FucOB活性位点的放大视图,展示了底物结合口袋。
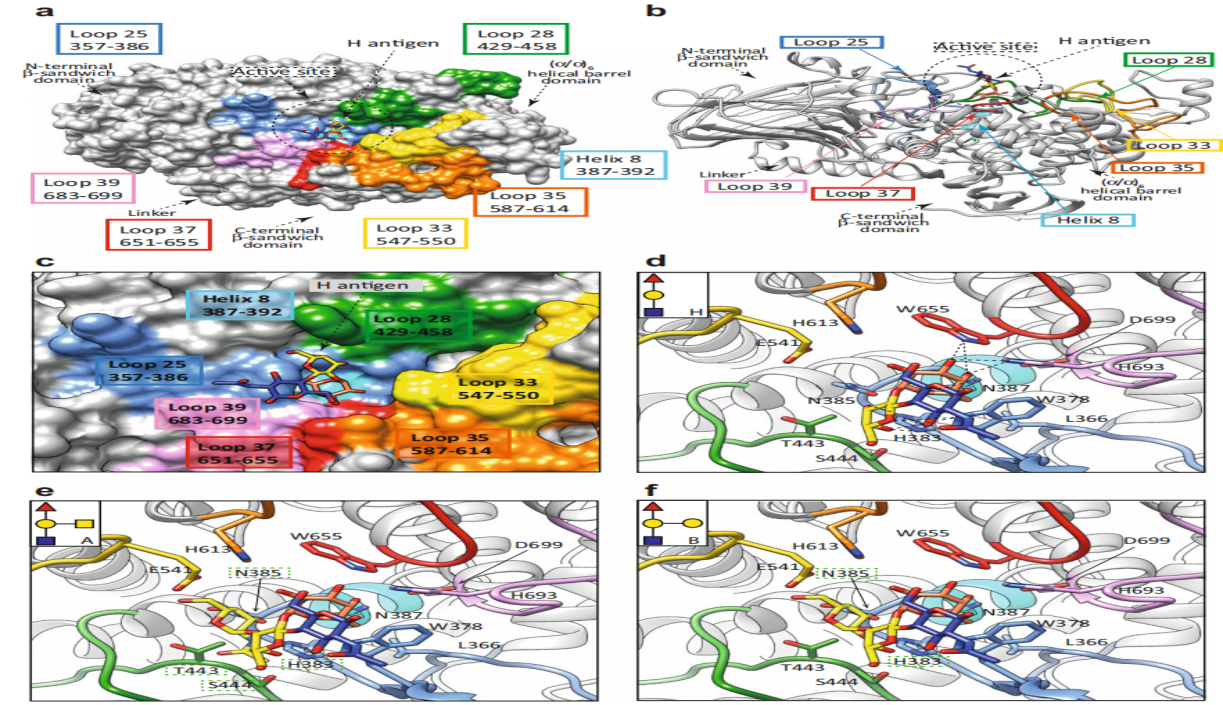
图3 FucOB对H型血型抗原特异性的结构基础
a. FucOB结构的表面表征,带有注释的结构域和环,显示了II型H抗原底物的位置。b. FucOB结构的动画表示,显示了II型H抗原底物的位置。c. 显示了II型H抗原进入活性位点的位置。FucOB与不同血型抗原的计算机模拟对接,d图为II型H抗原、e图为II型A抗原,f 图为II型B抗原,预测的不吻合氨基酸位点以绿色虚线方块表示,氢键以黑色虚线表示。
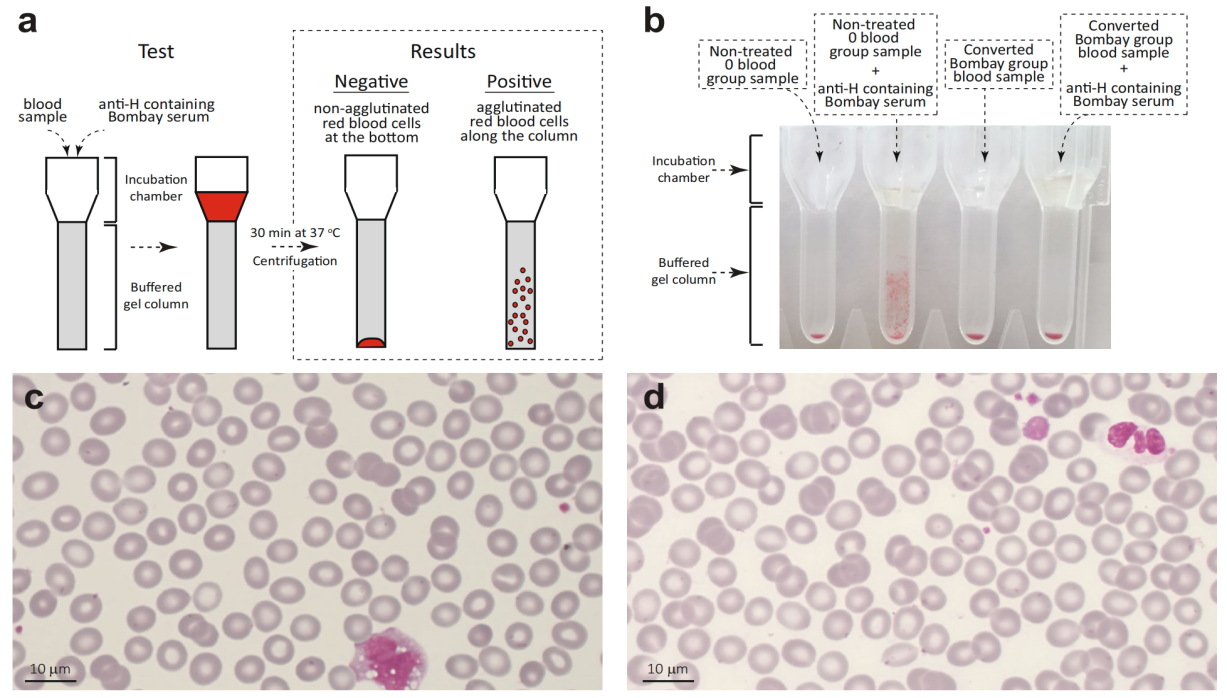
图4 将通用O型血转化为罕见的孟买型血
a. DG凝胶卡进行凝集试验的示意图 b.凝集实验结果图,第一列为未处理O型血样本无凝集,第二列为未处理O型血样本与H抗体混合后有凝集,分别作为阴性和阳性对照;第三列为转化后(O细胞FucOB处理后)的孟买血型样本,显示为无凝集;在接触H抗体后,转化后的孟买血型样本仍无凝集。c.d. 未经处理的O血型涂片,显示为正常双凹圆盘形态的红细胞,转化后的孟买O型样本血涂片,显示红细胞仍保持正常的双凹圆盘形态。
3主要结论
本研究发现粘蛋白降解菌(A. muciniphila)可以产生FucOB,它是一种α-1,2-岩藻糖苷酶,能够特异性水解H抗原,从而在体外将通用O型血转化为罕见的孟买型血。FucOB作为α-1,2-岩藻糖苷酶具有其独特优势。首先,FucOB产量及纯度高,每升可达5.0毫克。其次,水解H抗原中岩藻糖所需FucOB的量非常低,为5微克/毫升。最后,FucOB将O型血转化为孟买型血的能力较强。本研究揭示了FucOB催化和特异性识别底物的分子机制,FucOB可作为一种有前景的生物技术和治疗工具,用于切割O型血红细胞中存在的岩藻糖,能够将通用O型血转化为稀有孟买型血,为孟买血型患者输血问题的解决提供了新的视角。
4文献来源
Turning universal O into rare Bombay type blood. Nat Commun. 2023 Mar 30;14(1):1765. doi: 10.1038/s41467-023-37324-z.
编译:张玲玲,王文婷 审校:尹文
03 将人类 A 型血肾脏通过酶法转化为通用 O 型血肾脏
1研究背景
ABO 血型抗原免疫原性强,在输血和肾移植等实体器官移植中,供受体血型需匹配,否则会引发抗体介导的器官损伤。而 O 型或 B 型血患者因 ABO 相容供体倾向分配给血型限制更强的受者,在获取相容移植物上存在劣势,平均等待时间是 A 型和 AB 型患者的 2 - 3 倍。ABO 血型不合移植虽为可行方案,但需术前脱敏和血浆置换。目前,将免疫原性移植物酶促转化为通用血型 O 成为新兴策略,虽已在人肺 A 型到 O 型、人肾 B 型到 O 型转化中有研究,但人肾 A 型到 O 型的转化尚未开展。本研究使用细菌Flavonifractor lastii的两种酶,采用常温和低温机器灌注技术,将人类 A 型血肾脏转化为通用血型 O,并通过模型对比,提供了临床上克服肾移植 ABO 相容性障碍的可行策略(图1)。

图1 ABO血型相容性和结构概述
2主要研究结果
2.1供体人口统计数据
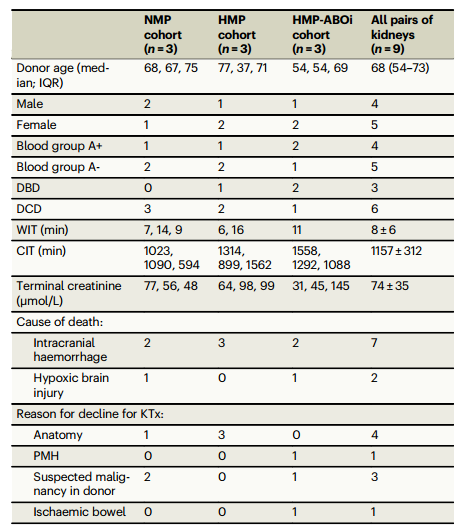
在 2022 年 7 月至 2023 年 5 月期间,研究纳入 9 名供体的 18 个 A 型血肾脏,分为三个队列:常温机器灌注组(NMP 队列)、低温机器灌注组(HMP 队列)、低温机器灌注后 ABO 不相容再灌注组(HMP-ABOi 队列),供体详情见表 1。
表1. NMP、HMP和HMP-ABOi队列中成对肾脏的供体人口统计学
2.2常温机器灌注过程中酶促A型抗原去除
先前研究显示 FpGalNAc 脱乙酰酶(FpGalNAc DeAc)和 FpGalN 酶(FpGalNase)可在常温灌注下去除人肺 A 型抗原,本研究据此对 3 对来自 DCD 供体的 A 型血肾脏(NMP 队列)开展实验,在约 37℃下以无细胞灌注液常温灌注 6 小时,每对中一个肾脏经动脉插管施用 1 mg/L 的两种酶(处理肾 “ABOe”),对侧肾为未加酶对照。通过免疫荧光显微镜分析活检组织并定量检测发现(图2a),处理 1 小时后,ABOe 肾 A 型抗原表达降至灌注前的 56%,显著低于对照组(p=0.0056),2 小时后降至 19%,而对照组无变化;处理 1 小时后,ABOe 肾 H 抗原表达增加 4.85 倍,与 A 型抗原向 H 抗原转化一致,6 小时未进一步变化,对照组 H 抗原无增加。研究表明,这两种酶在常温灌注下可有效去除人肾 A 型抗原并转化为 H 抗原,验证了酶促血型转化的可行性。
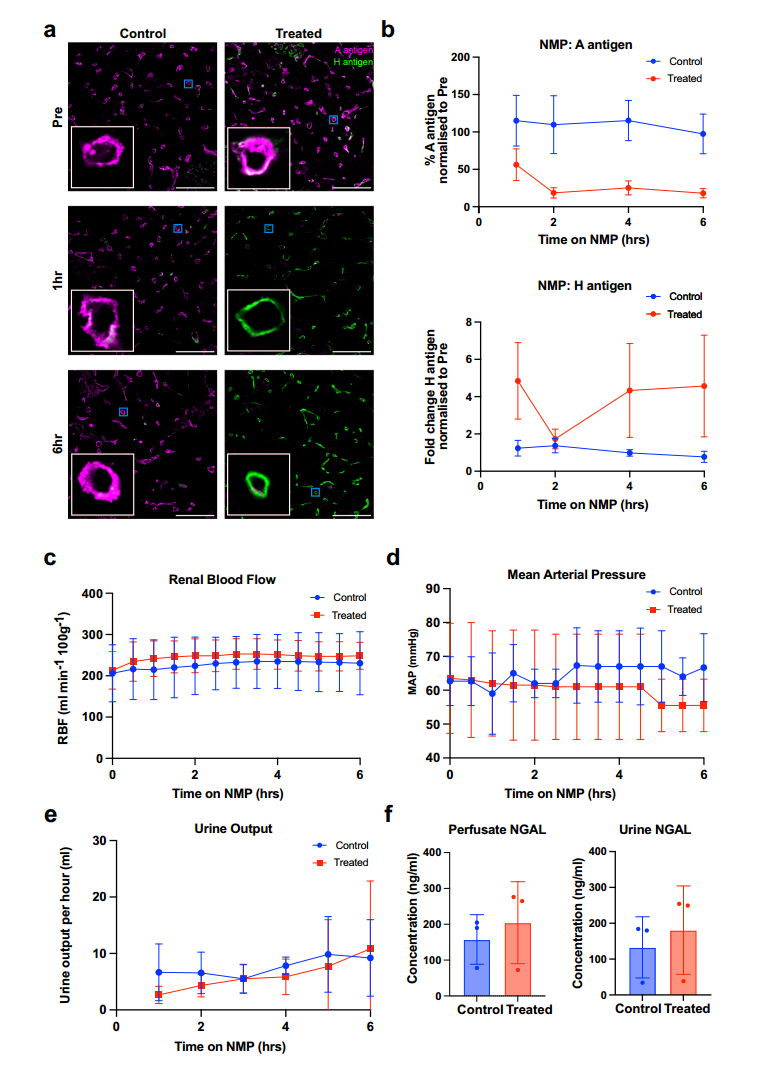
图2 常温机器灌注(NMP)过程中A型血型抗原的清除
2.3 NMP期间FpGalNAc DeAc和FpGalNase治疗对肾功能的影响
在常温灌注过程中,研究通过连续监测肾血流量(RBF)、平均动脉压(MAP)、尿量及肾损伤标志物等,评估 FpGalNAc 脱乙酰酶和 FpGalN 酶处理对肾脏功能的影响。结果显示,对照组与治疗组(ABOe 肾)的 RBF 和 MAP 在 6 小时灌注期间均保持稳定且无显著差异(图2cd,RBF:对照组 230±76 vs 治疗组 249±33 ml?min?1?100g?1,p=0.75;MAP 因数据缺失未统计),两组平均总尿量也无显著差异(图2e,对照组 46±10 vs 治疗组 37±28 ml,p=0.75)。组织学分析显示,两组肾脏损伤分级无差异,肾小管变平主要由冷缺血期缺血性损伤引起。肾损伤标志物 NGAL 在灌注液和尿液中的浓度在两组间均无显著差异(图2f,灌注液:p=0.5;尿液:p=0.25)。综上,酶处理未对肾脏血流动力学、泌尿功能及组织完整性产生显著不良影响,证实了该酶促血型转化方法在肾脏中的安全性。
2.4低温机灌注中酶法去除血型A抗原的研究
在常温灌注实验证实酶处理安全性后,研究进一步利用临床常用低温灌注设备 LifePort Kidney Transporter,对三对 A 型肾脏开展低温机器灌注(HMP,约 4°C)下 FpGalNAc 脱乙酰酶和 FpGalN 酶去除 A 型抗原的研究,每对中一肾经酶处理(ABOe 肾),另一肾为对照,并通过免疫荧光显微术分析不同时间点(1 小时、2 小时、6 小时、12 小时、24 小时)的活检组织(图 3a)。结果显示,酶处理 1 小时后 A 型抗原表达无显著变化(p=0.2856;图 3b),2 小时后显著降低至约 20%(p=0.0015;图 3b)并维持至 24 小时;H 抗原表达在处理 1 小时后较对照增加 3.36 倍(p=0.0204;表 3),4 小时达峰值(约 35 倍),虽 24 小时有所下降,但各时间点均显著高于对照组,且峰值增幅远超常温灌注组的 4.85 倍最大值。连续评估肾功能参数,在6小时对照和处理的肾脏之间在RBF方面没有观察到显著差异(p = 0.9375)或24 h(p = 0.5000;图3c)。该研究表明,HMP 下酶处理虽起效较慢,但 H 抗原生成效率更高,且因 HMP 是临床成熟的灌注策略,更易整合到现有流程中,进一步验证了低温环境下酶促血型转化的可行性与潜在优势。
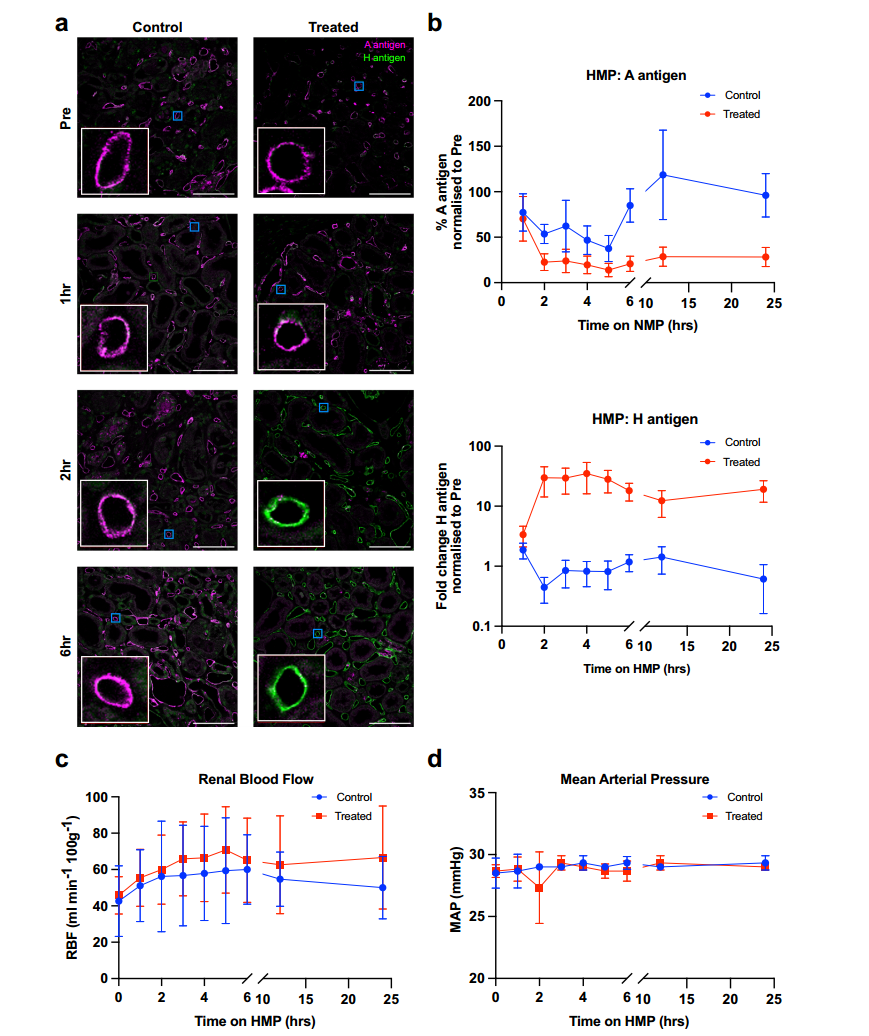
图3 低温机器灌注(HMP)期间A血型抗原的清除
2.5 NMP与HMP期间A型血抗原清除的比较
|
|
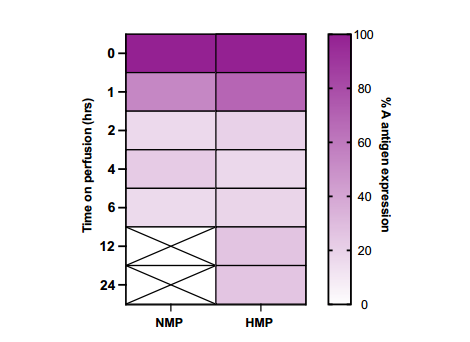
图4 比较FpGalNAc DeAc和FpGalNase处理肾脏的NMP与HMP中A型血型抗原丢失的热图总结
2.6 在ABOi再灌注模型中,ABOe肾脏不结合循环抗体
在证实 FpGalNAc DeAc 和 FpGalNase 可在常温(NMP)及低温(HMP)灌注下去除血型 A 抗原后,研究进一步构建离体模型评估 ABOe 肾脏(酶处理转化为 O 型的 A 型肾)对 ABO 不相容免疫挑战的耐受性。结果显示,ABOi 再灌注阶段,对照组(未处理)与治疗组(ABOe 肾)的血流动力学参数无显著差异:肾血流量(RBF,p=0.25;图 5a)、平均动脉压(MAP,p=0.75;图 5b)保持相似;总尿量虽在 ABOe 组数值更高(74±36 vs. 42±15 ml,p=0.5),但未达统计学显著;两组估计肾小球滤过率(eGFR)亦无差异(图 5d)。该模型表明,酶促血型转化后的 ABOe 肾脏在 ABO 不相容条件下仍能维持正常血流动力学和滤过功能,验证了其抵抗免疫攻击的潜力。
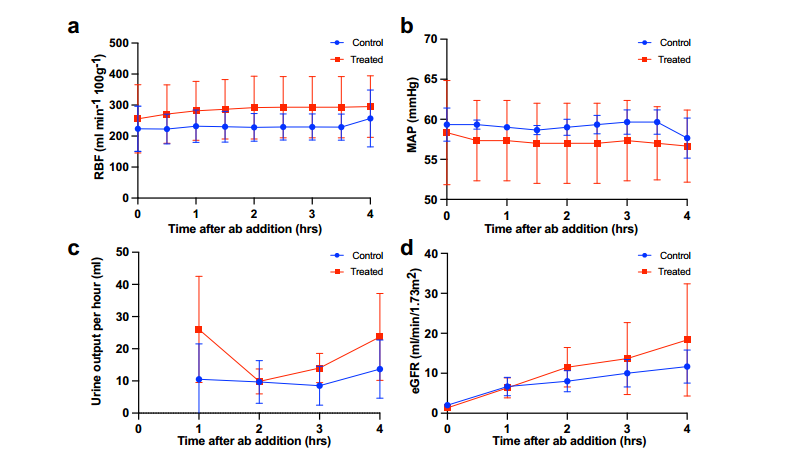
图5 ABO血型不合再灌注期间的血液动力学参数
为评估循环抗体与酶处理的 ABOe 肾脏血管表面的结合情况,研究对再灌注后的活检组织进行荧光标记山羊抗鼠 IgM 染色(图 6a),发现 ABO 血型不相容对照肾(ABOi)的肾小管周围毛细血管表面有显著小鼠 IgM 沉积,内皮细胞 IgM 沉积量显著高于 ABOe 肾(p<0.0001;图 6b),而 ABOe 肾仅见极少量抗体结合,表明其血管表面抗原极少与抗 A 抗体结合。进一步通过红细胞流式细胞术测定灌注液中抗 A 抗体含量,将含抗体的灌注液与 A 型红细胞孵育后,ABOi 对照组中荧光标记抗鼠 IgM 的平均荧光强度(MFI)随灌注时间稳定下降,4 小时后循环抗体水平降至 28.4%±7.4%,而 ABOe 组抗体水平维持在 101.3%±21.6%(图 6c,d)。结果表明,ABOi 肾的血管内皮抗原与抗 A 抗体结合导致循环抗体消耗,而 ABOe 肾因表面 A 型抗原几乎被清除,未引发抗体显著消耗,证实酶促血型转化后的 ABOe 肾脏可有效逃避抗 A 抗体识别,为 ABO 不相容移植中规避免疫攻击提供了可行策略。
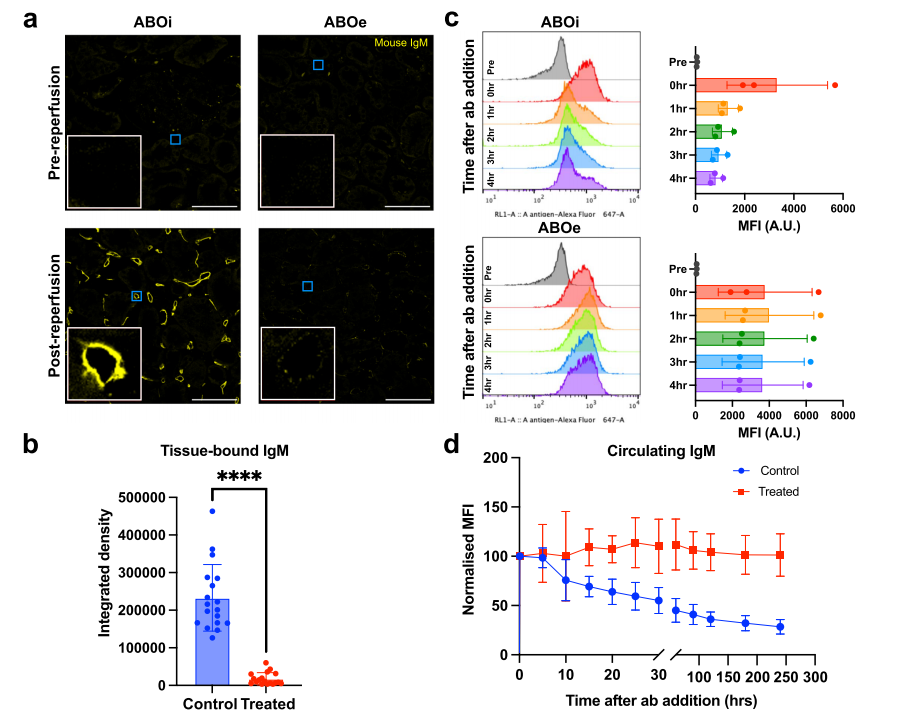
图6 ABO血型不合再灌注期间的抗A结合
2.7 ABOi肾脏中经典补体途径的激活,而非ABOe肾脏
急性抗体介导的排斥反应以经典补体途径激活为特征,研究通过检测补体成分评估对照(ABOi)和 ABOe 肾脏在再灌注期间的补体激活情况。免疫荧光显微术显示,ABOi 肾中 C1q 蛋白亚基 C1qA 与抗 A 小鼠 IgM 共定位并结合于微血管系统,C4d 和 C5b-9(膜攻击复合物)也特异性定位于其微脉管,而 ABOe 肾组织中未见这些补体成分沉积(图 7b)。结果表明,ABOi 模型中 IgM 与抗原结合激活 C1q,启动了经典补体途径,而 ABOe 肾因未结合循环抗 A 抗体,可避免补体激活长达 4 小时,证实了酶促血型转化策略通过阻止抗体 - 抗原结合及补体级联激活,从而规避超急性抗体介导排斥的关键机制。
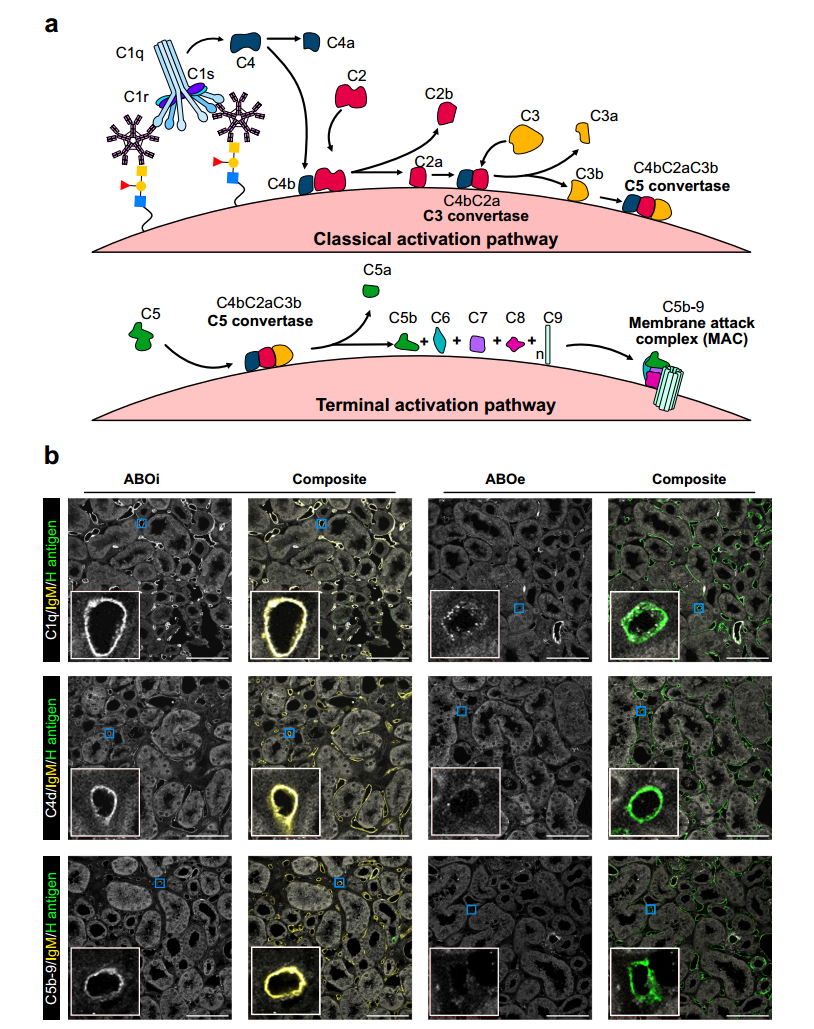
图7 ABOi再灌注期间经典补体级联的激活
3主要结论
利用细菌来源的糖苷水解酶结合机器灌注技术,可安全、有效地将 A 型肾脏转化为通用 O 型,且在 ABO 不相容条件下能维持正常功能并规避免疫攻击。该策略为扩大肾移植供体池、缩短 O 型 / B 型血患者等待时间提供了临床可行的新路径,尤其低温灌注方案更具临床转化潜力。
4文献来源
MacMillan S, Hosgood SA, Walker-Panse L,et al. Enzymatic conversion of human blood group A kidneys to universal blood group O. Nat Commun. 2024 Mar 30;15(1):2795. doi: 10.1038/s41467-024-47131-9.
编译:刘志新,王文婷 审校:尹文