PRP水凝胶促进子宫内膜损伤修复最新研究进展
中国输血协会临床输血管理学专业委员会组稿
空军军医大学第一附属医院输血科组织编译
本期《输血医学新进展》聚焦富血小板血浆(PRP)技术在子宫内膜损伤治疗中的最新研究进展。通过分享三篇最新发表的文献,分别从水凝胶结构优化、信号通路靶向调控以及临床转化研究三个维度,系统阐述了PRP在促进子宫内膜损伤修复中的跨学科应用。研究表明,将PRP与生物材料相结合,能够实现从被动递送向激活响应型修复的转变。这种创新方法通过延长效应因子释放、增强干细胞协同作用以及调控微环境,为解决子宫内膜再生中的结构修复与功能重建等关键问题提供了重要的理论依据和实践指导。
可注射透明质酸/壳聚糖水凝胶作为PRP和干细胞载体来促进子宫内膜再生和生育恢复
编译者:党娥 王文婷 审校者:尹文
1. 研究背景
刮宫术、子宫肌瘤切除术以及子宫内膜结核、子宫内膜炎等,均会导致子宫内膜上皮细胞损伤、间质区域暴露并被纤维组织替代而形成纤维化和无血管瘢痕,严重破坏子宫内膜的再生能力,最终导致子宫内膜变薄、功能异常。薄型子宫内膜存在氧化应激、血管生成受损、新生血管不足、血流灌注不足等问题,这些问题导致子宫内膜容受性降低,引发反复流产,增加产科并发症等风险,给患者带来沉重心理压力和经济负担。间充质干细胞(尤其是脂肪来源干细胞)和PRP在子宫内膜再生中应用前景良好。但由于PRP的生长因子易被酶降解、被机体免疫系统清除,直接注射难以维持较高活性和浓度;而仅进行干细胞移植则存在植入效率低,受损内膜中的活性氧影响干细胞存活。基于PRP与干细胞治疗的局限性,本研究拟开发一种可注射、redox响应型透明质酸/壳聚糖水凝胶作为PRP和干细胞载体,来修复受损内膜。
2. 主要结果
该研究开发了一种由硫醇化透明质酸(t HA)和硫醇化壳聚糖(t Chi)组成的可注射、抗氧化、redox 响应型水凝胶,用于包裹富血小板血浆(PRP)和脂肪来源干细胞(ADSCs),旨在促进子宫内膜再生及生育力恢复。主要结果如下:
2.1水凝胶的理化特性
t HA和 t Chi通过硫醇基团形成二硫键,在 37℃中性条件下原位交联成胶,凝胶化时间约300秒(图1B)。FTIR证实二硫键和氢键的存在(图1C),SEM显示其具有互联多孔结构(图1D)。
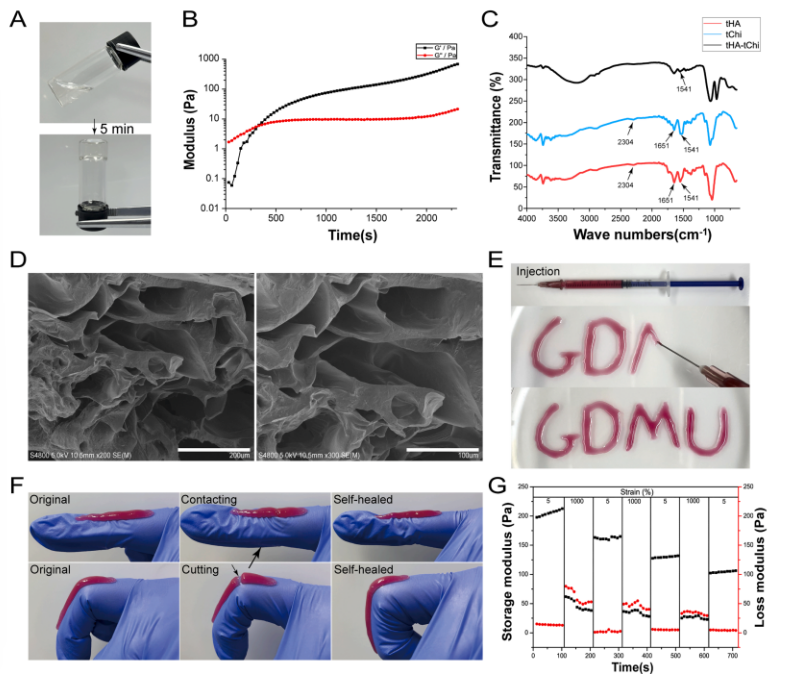
图1 t HA-t Chi 水凝胶形成及理化特性表达试验
2.2缓释与生物相容性
2.2.1 PRP生长因子缓释:水凝胶显著降低PRP中VEGF、PDGF、EGF的初始释放率,并实现10天以上的持续释放(图 2)。
2.2.2 生物相容性:对人脐静脉内皮细胞(HUVECs)和 ADSCs无毒性,ADSCs包封7天后存活率高。体内降解:皮下注射后14天基本降解,炎症反应轻微(图2F-G)。
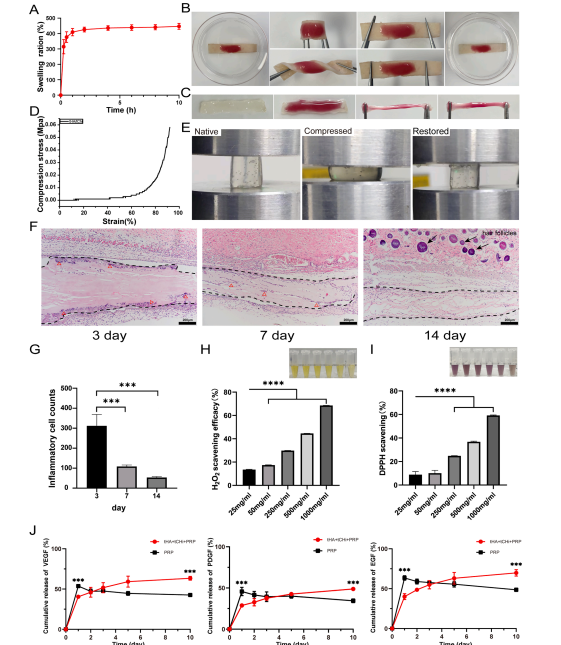
图2 水凝胶的理化特性、体内降解、抗氧化能力及PRP 生长因子释放性能评估
2.3促血管生成与子宫内膜修复
2.3.1体外实验:ADSCs/t HA-t Chi/PRP组显著促进HUVECs增殖、管腔形成,上调VEGF和HIF-1α的mRNA及蛋白表达(图3B-F)。
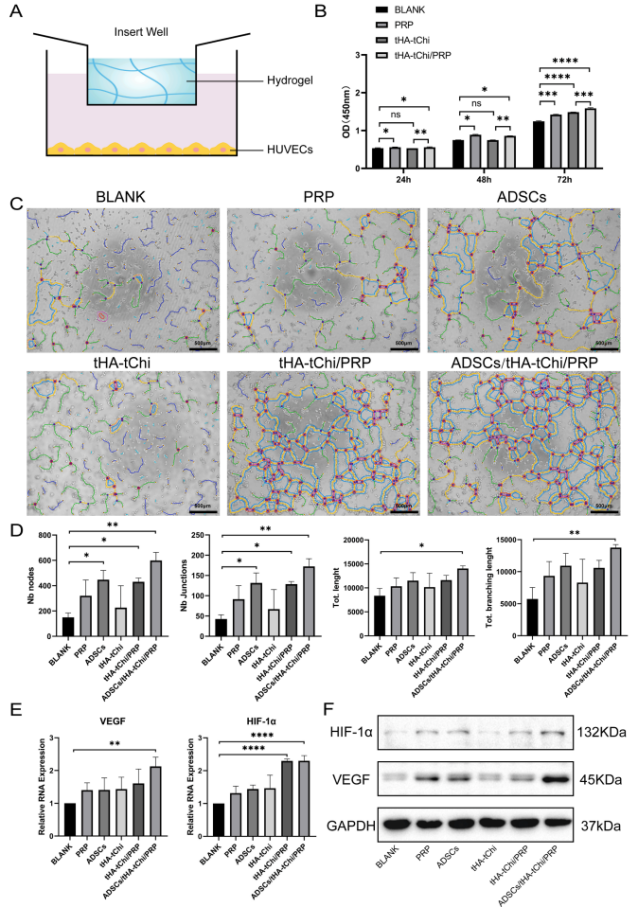
图3 水溶胶生物相容性和促进血管生成能力实验
2.3.2体内实验(小鼠薄子宫内膜模型):子宫内膜厚度从模型组的126μm增至372.4μm,腺体数量从2.5个增至44个(图4C-E)。
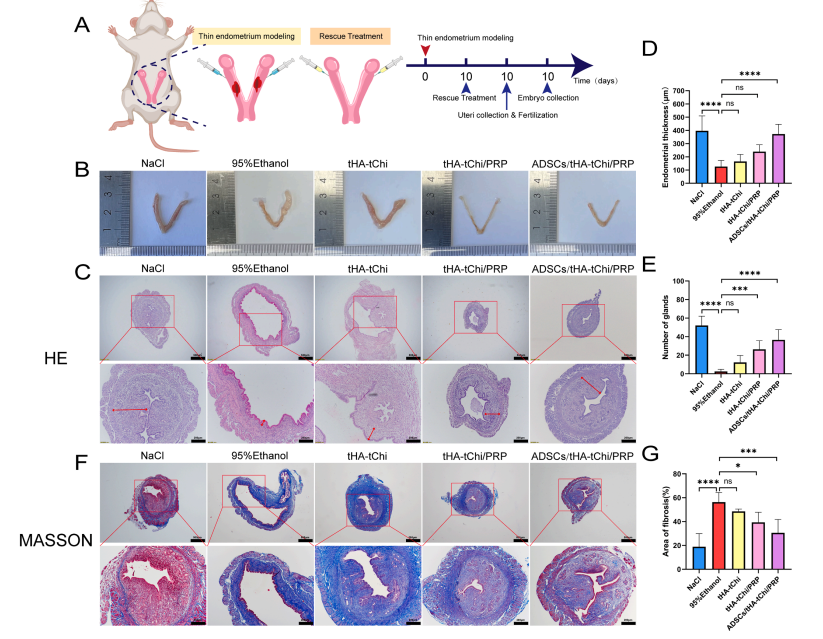
图4 不同方法对薄型子宫内膜小鼠模型子宫内膜修复效果试验
纤维化面积显著减少(Masson 染色,图4F-G),细胞增殖(Ki67)和上皮修复(CK19)标志物表达升高(图5A-D)。
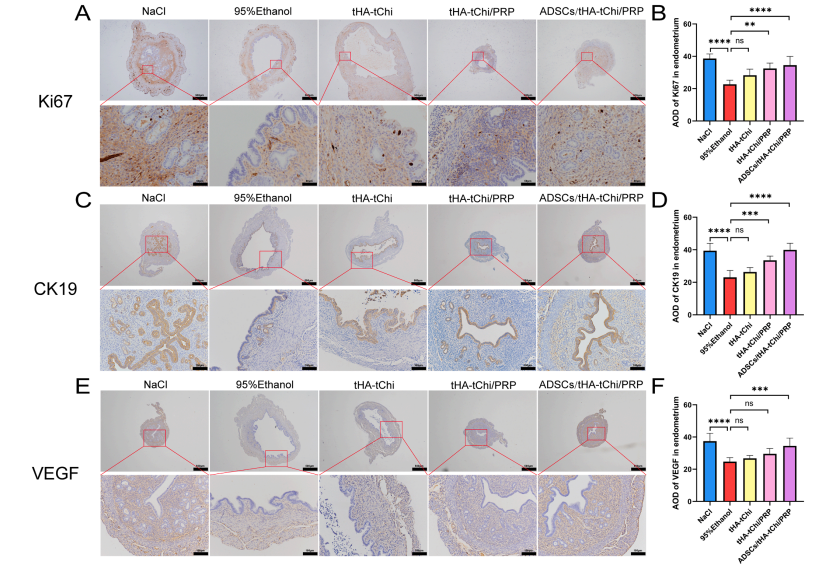
图5 不同方法对小鼠子宫内膜血管生成影响实验
2.4 生育力恢复及其分子机制
2.4.1分子机制:通过激活VEGF/AKT/BAD通路,上调VEGF、VEGFR2、磷酸化AKT表达,降低促凋亡蛋白BAD水平,促进血管生成和细胞存活(图6D-E)。
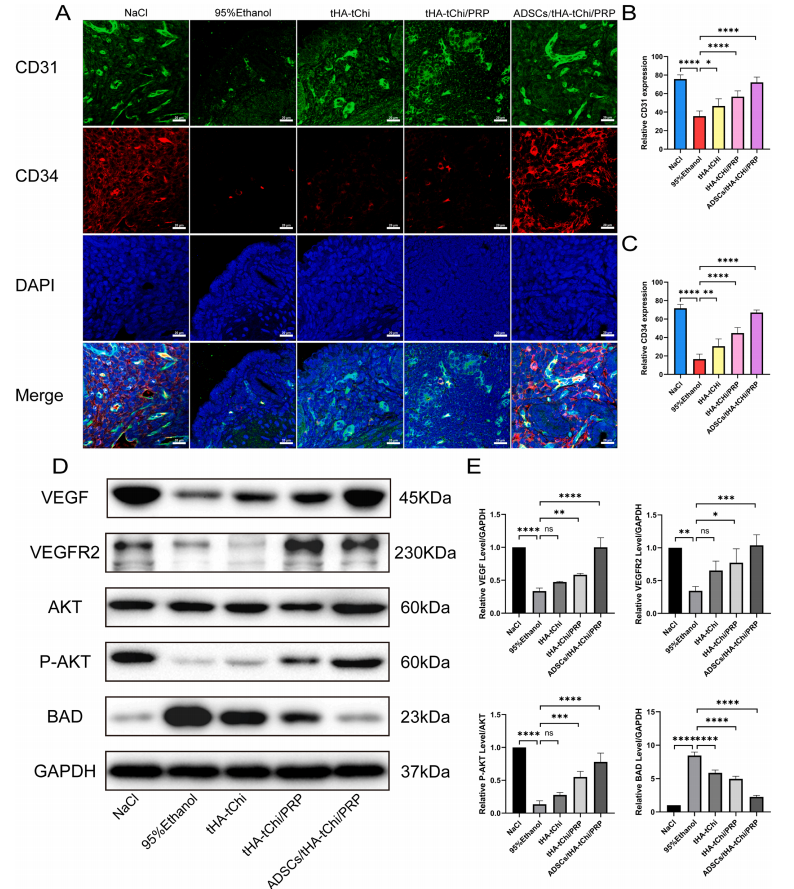
图6 不同方法对小鼠子宫内膜血管生成及蛋白表达影响实验
2.4.2妊娠结果:ADSCs/t HA-t Chi/PRP 组胚胎着床数量从模型组的2个增至13个(图7)。
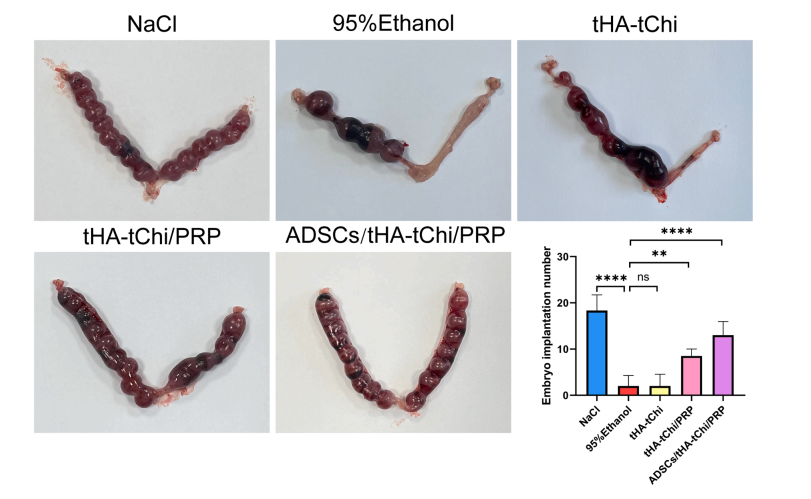
图7 不同方法对小鼠子宫内膜容受性及胚胎着床数量影响试验
3. 主要结论
该研究表明可注射、具抗氧化性的硫醇化透明质酸/壳聚糖水凝胶,能有效包封富血小板血浆和脂肪源性干细胞,持续释放PRP生长因子,刺激内皮细胞血管生成。在薄子宫内膜小鼠模型中,该水凝胶可通过调控VEGF/AKT/BAD通路来促进子宫内膜再生,增加子宫内膜厚度、减少纤维化,提高子宫内膜容受性和妊娠率,为子宫内膜疾病提供了新型微创治疗选择。
4. 文献来源
Zheng XD, Huang R, Yin LL, Yao MH, Chu JQ, Yang FK, et al. Injectable antioxidant hyaluronan/chitosan hydrogel as a platelet - rich plasma and stem cell carrier to promote endometrial regeneration and fertility restoration. Acta Biomaterialia.2025:195:201-215.
可注射的双网络水凝胶定位激活PRP促进子宫内膜再生
编译者: 魏贤 王文婷 审校者:尹文
1.研究背景
宫腔粘连(IUA)是导致子宫性不孕的主要原因。目前临床治疗方案主要为宫颈粘连分离术、物理屏障、雌激素治疗,但仍无法有效预防复发或存在激素治疗副作用。改善局部子宫内膜微环境是IUA治疗关键,但局部用药面临多重挑战:子宫中空且与阴道相通,直立体位时药物易流出;宫腔容量小限制用药剂量,且用药浓度不均导致内膜增生异常;现有的生物材料在治疗中也存在贴合度差、伤口隔离效果不佳、过度压迫等问题,阻碍内膜修复。PRB已被证实可促进内膜再生,但其临床治疗效果不一,核心问题在于PRP机械性能差、需凝血酶/氯化钙短暂激活、激活后成凝胶状无法注射致覆盖不全。而PRP水凝胶也存在不适配子宫中空结构、无体内自修复与激活能力、生长因子释放过快等局限性。因此,本研究拟通过开发可注射、多孔、可降解的双网络水凝胶(PRP@GEL),通过定位激活PRP、实现生长因子持续释放,并赋予其快速凝胶化、自愈合、促增殖、促血管生成及抗纤维化特性,以突破IUA治疗困境,推动内膜修复与生育能力恢复。
2.主要结果
2.1 双网络PRP水凝胶(PRP@GEL)的表征与性能
本研究开发的水凝胶 PRP@GEL具有增强的机械强度和快速自愈能力,这使得其在子宫内膜再生过程中能够保持结构完整性。HAMA-PBA 的合成、可注射性及其可降解性见(图1A-D)。PRP@GEL的流变特性及其自修复性能,以及单网络水凝胶与双网络水凝胶之间的差异见(图1E)。PRP@GEL的交联密度增加,孔径减小,多孔结构更加致密(图1F)。
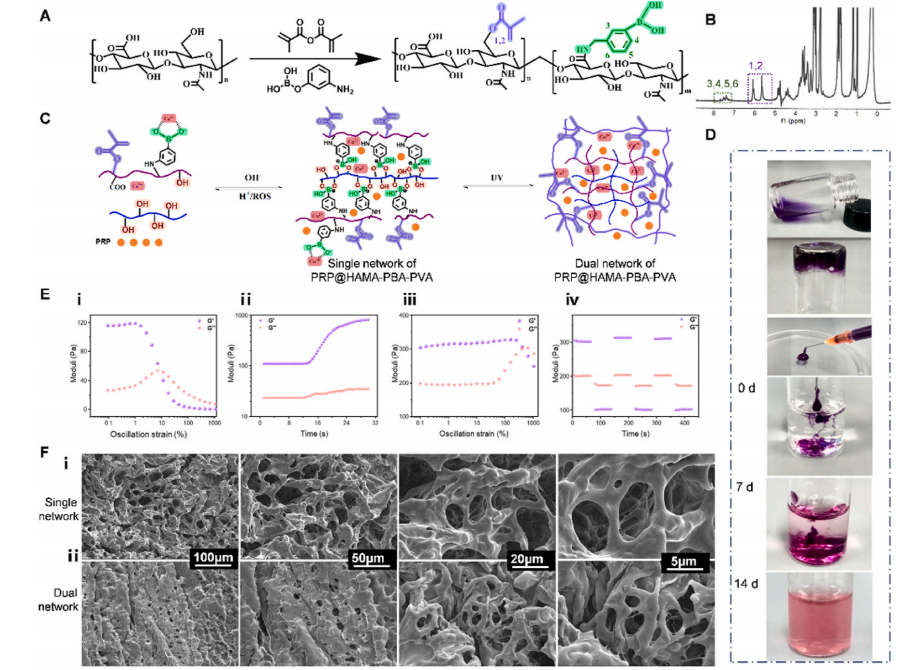
图1 水凝胶的特性
2.2 PRP@GEL体外功能的验证
2.2.1 PRP@GEL生长因子缓释效应并促进细胞增殖:PRP及双网络PRP@HAMA-PBA-PVA水凝胶中PDGF 、EGF和VEGF的释放动力学曲线(图2A-C),PRP@GEL显著促进子宫内膜基质细胞(HESCs)和血管内皮细胞(HUVECs)增殖(图2D-I)。
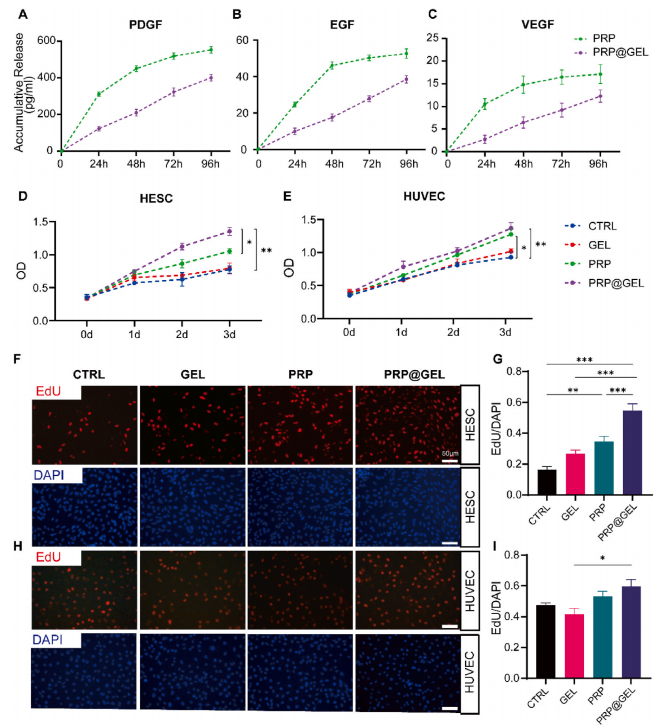
图2 水凝胶生长因子释放与生物相容性
2.2.2 PRP@GEL可抗子宫内膜基质细胞(HESCs)纤维化:PRP@GEL可抑制TGF-β1-SMAD2/3通路,下调胶原沉积基因(COL1A1/ACTA2/CTGF)(图3B-D);PRP@GEL抑制了TGF-β1诱导的COL1A1、α-SMA 和CTGF蛋白的生成(图E-L)。
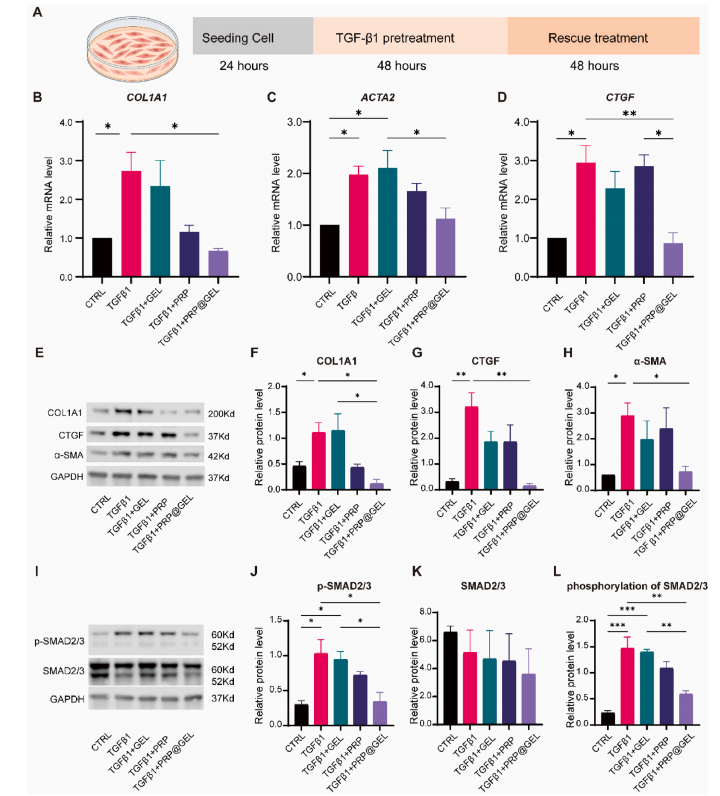
图3 PRP@GEL对子宫内膜基质细胞(HESCs)体外纤维化的影响
2.2.3 PRP@GEL可促进人脐静脉内皮细胞(HUVECs)迁移、侵袭及血管生成:PRP@GEL促进HUVECs迁移、侵袭及成管能力,上调促血管生成基因(VEGFA/PDGFA)(图4)。
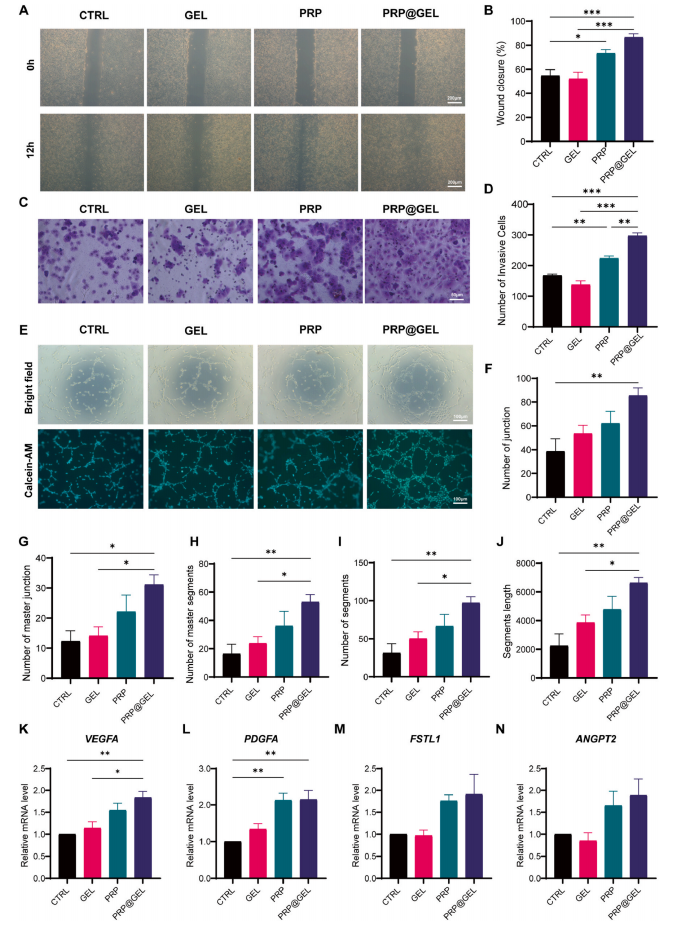
图4 PRP@GEL对人脐静脉内皮细胞(HUVECs)迁移、侵袭及血管生成的影响
2.3 双网络PRP水凝胶在IUA动物模型中的疗效
2.3.1促进子宫内膜增殖:在子宫内膜再生验证实验中,采用大鼠IUA模型中,PRP@GEL治疗组子宫内膜厚度、腺体数量恢复接近正常(图5B-C),为了进一步评估大鼠体内抗纤维化效果,作者进行马松染色以检测子宫内膜胶原沉积情况,发现PRP@GEL治疗组胶原沉积减少(图6)
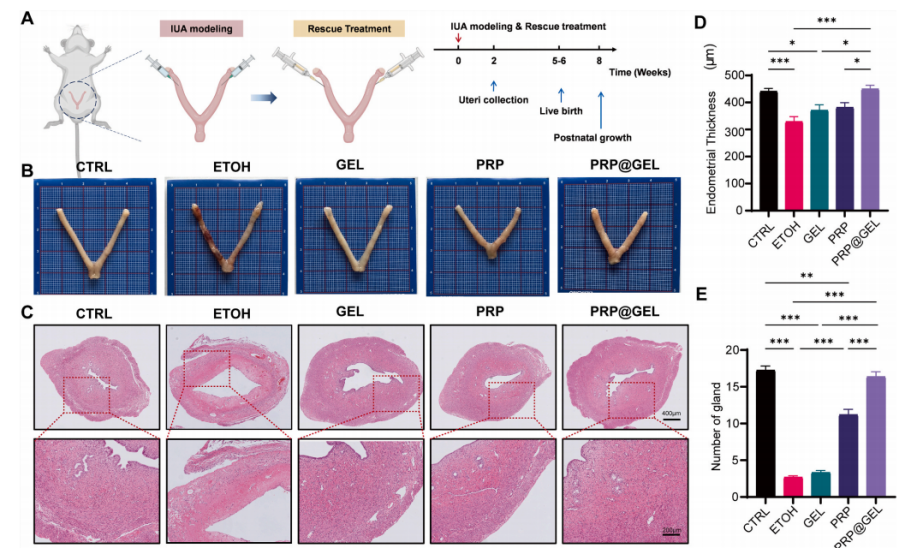
图5 PRP@GEL 在恢复子宫内膜厚度和腺体数量的体内效果
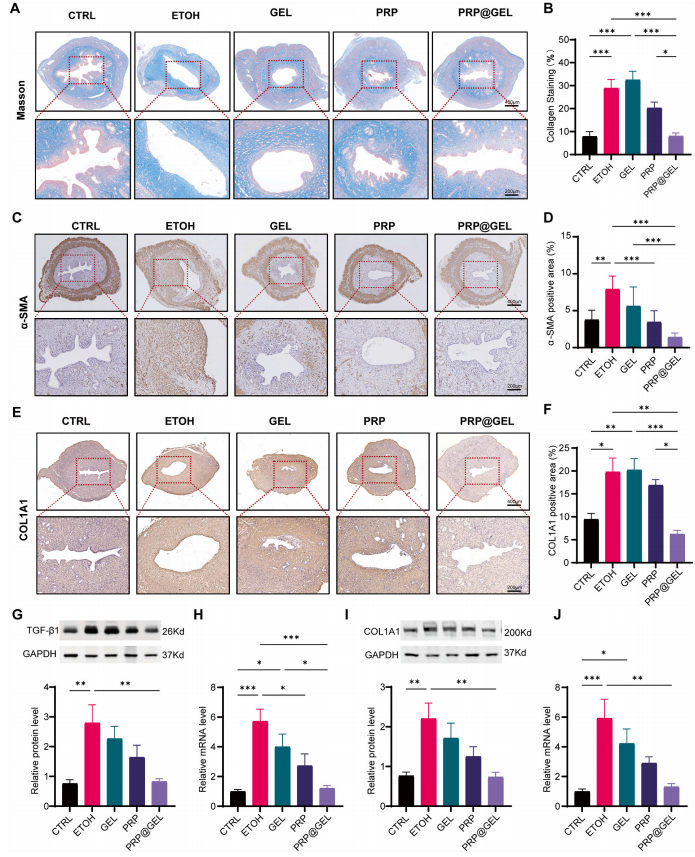
图6 PRP@GEL在子宫内膜胶原沉积中的体内效应
2.3.2 PRP@GEL促进血管生成:由于子宫内膜再生依赖于血管生成来修复组织,作者进一步使用 IUA大鼠模型证实了 PRP@GEL在体内诱导新生血管形成。大鼠子宫的免疫组化染色显示,与 ETOH 组相比,PRP@GEL 组中 CD31 和 VWF 的表达更高,血管密度也增加。(图7)
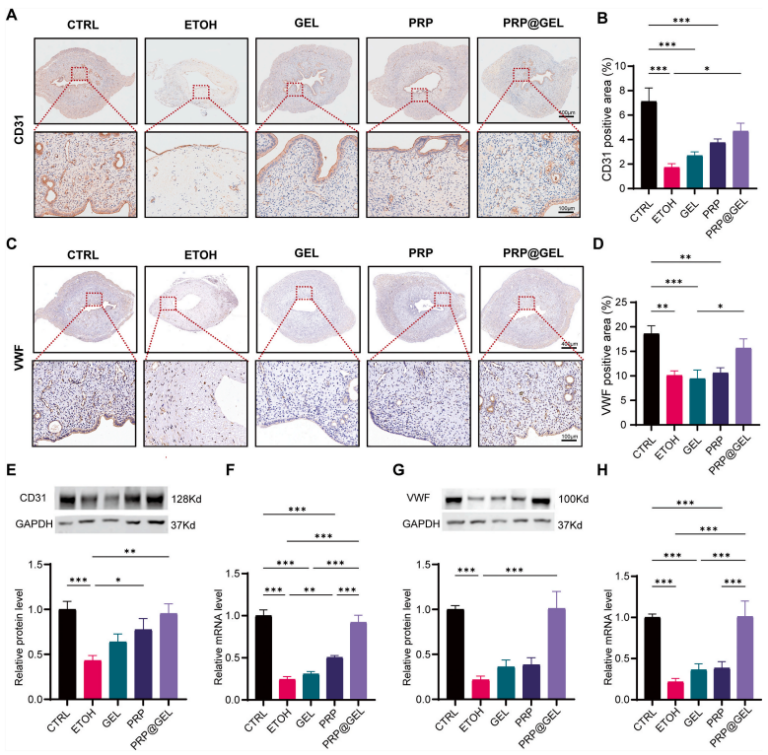
图7 PRP@GEL 对子宫内膜血管生成的体内影响
2.3.3 促进生育功能的恢复:恢复生育能力被认为是子宫内膜再生的最终目的。作者进行了一系列全面的生育能力实验,包括大鼠胚胎数量、胚胎发育和活产情况,证实了PRP@GEL 能够有效修复受损的子宫,使其恢复生育率(图8A-F),且产下健康的后代可正常喂养(图8G)。
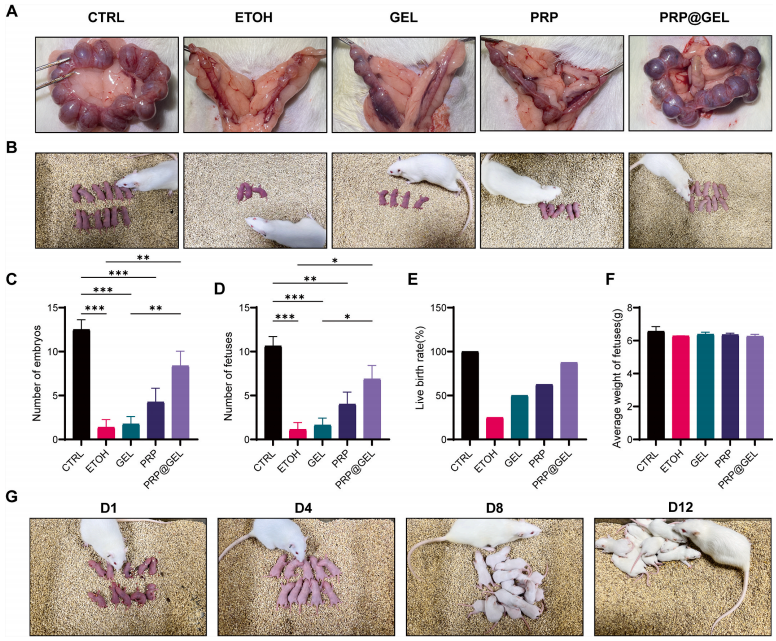
图8 不同干预措施大鼠的妊娠结局
3. 主要结论
可注射双网络水凝胶(PRP@GEL)通过定位激活PRP,有效促进子宫内膜细胞增殖、血管生成、通过制人子宫内膜间充质干细胞中的 TGF-β1-SMAD2/3 信号通路下调胶原沉积基因的表达,抑制子宫内膜纤维化,并促进子宫功能的恢复且提高活产率。这些发现对治疗子宫内膜修复具有重要的意义,也在其他组织再生应用中展现出潜力。未来可通过注射双网络水凝胶实现定位激活PRP ,为宫腔粘连(IUA)治疗提供了新的途径。
4. 文献来源
Qi J, Li X, Cao Y, Long Y, Lai J, Yao Y, Meng Y, Wang Y, Chen XD, Vankelecom H, Bian X, Cui W, Sun Y. Locationally activated PRP via an injectable dual-network hydrogel for endometrial regeneration. Biomaterials. 2024 Sep;309:122615. PMID: 38759486.
可注射的负载PRP水凝胶通过调控PI3K/AKT通路修复子宫内膜损伤及重塑生殖功能
编译者:吴粉毅 王文婷 审校者:尹文
1. 研究背景
当前全球不孕率持续上升,中国育龄夫妇不孕率达12%-15%,发达国家约8.5%-20%,子宫内膜损伤是核心诱因之一。常见损伤类型有薄型子宫内膜(TE)和宫腔粘连(IUA)。TE是指黄体中期内膜厚度≤7mm,TE会导致胚胎植入失败率升高,40岁以上女性发病率达25%;而IUA在人工流产术后发生率为19%,宫腔镜电切术后则高达20-62.5%,表现为闭经、周期性腹痛及不孕。现有治疗手段包括药物疗法、手术干预、生物疗法以及器械辅助,但复杂的宫腔生理环境使传统疗法难以长效发挥作用并促进功能性再生。PRP含VEGF、EGF、TGF-β等生长因子,可促进血管新生、抑制纤维化、加速细胞增殖,但是直接注射后活性因子72小时内流失,无法持续作用于损伤部位,宫腔收缩和分泌物冲刷导致PRP溢出,生物利用率不足30%。因此,研究者通过动态希夫碱交联构建可注射水凝胶(HOH),包裹PRP形成缓释系统,实现其长效粘附和自愈合能力,通过激活PI3K/AKT通路促进血管生成,同步抑制纤维化。
2.主要结果
2.1水凝胶的制备与表征
通过动态希夫碱交联制备由羟丁基壳聚糖(HBC)和氧化葡聚糖酐(ODA)组成的水凝胶(HOH),HBC和ODA分别由壳聚糖(CS)和葡聚糖酐(DA)改性而成(图1B-C)。水凝胶的物理特性:①自愈合性:断裂后60秒内重组(图1G)。②可注射性:可塑形适应宫腔病变形态(图1K)。③组织粘附:剩余醛基与子宫内膜氨基共价结合,实现长效粘附(图1L)。④力学性能:流变分析显示断裂强度2350 Pa,应变率160%(图1E-F)。⑤缓释与降解:多孔结构负载PRP形成HOHP,体外缓释实验显示生长因子释放周期延长(图1I);体内降解实验证实21天完全降解,无子宫内膜损伤(图1J)。
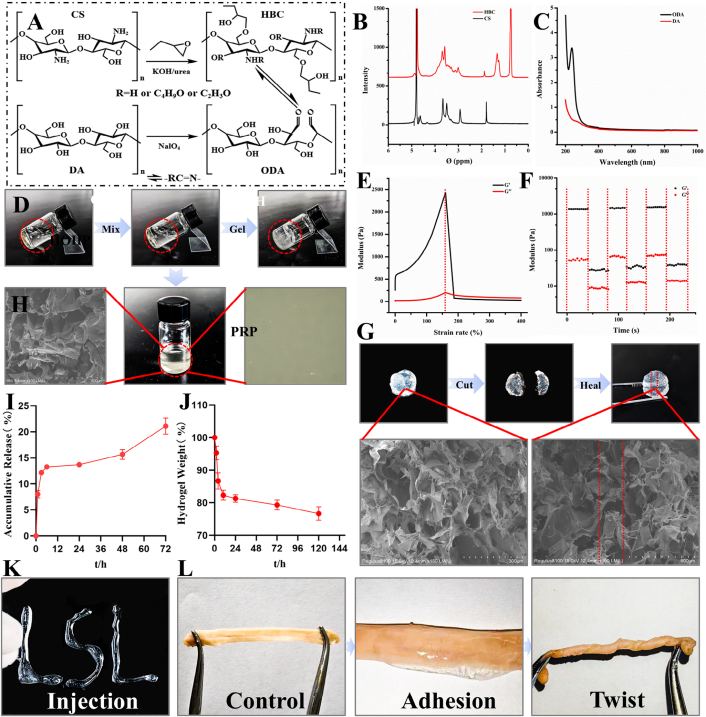
图1 HOHP的制备和表征
2.2细胞相容性与增殖实验
使用Ishikawa细胞模拟子宫内膜上皮和HUVECs(人脐静脉内皮细胞)。5% PRP浓度显示最适宜,20% PRP抑制增殖(图2A-B)。生物相容性实验结果显示:细胞染色和CCK-8实验证实HOHP无细胞毒性,细胞增殖率显著高于对照组(N)、HOH组和PRP组(图2C-D)。增生迁移促进结果显示,HOHP组细胞迁移数显著增加,Ishikawa细胞迁移率提升40%,HUVECs提升35%(图2E-H)。
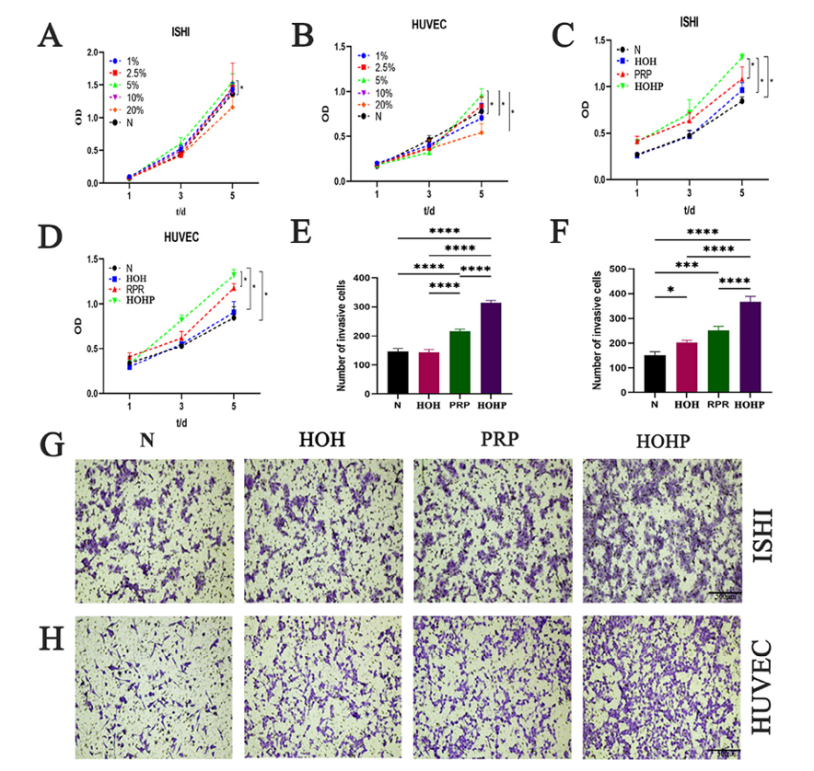
图2 水凝胶的体外细胞相容性和体内降解性
2.3血管生成相关因子调控
体外血管生成实验结果显示HOHP组初级连接点、管段长度显著增加(图3A-F)。RT-PCR和Western blot结果证实HOHP上调VEGFA、PDGFA、ANG-1和CXCR4(图3G-I,L),VEGFA蛋白表达增加激活PI3K/AKT通路(p-PI3K和p-AKT水平升高,图3J-K,M-N)。
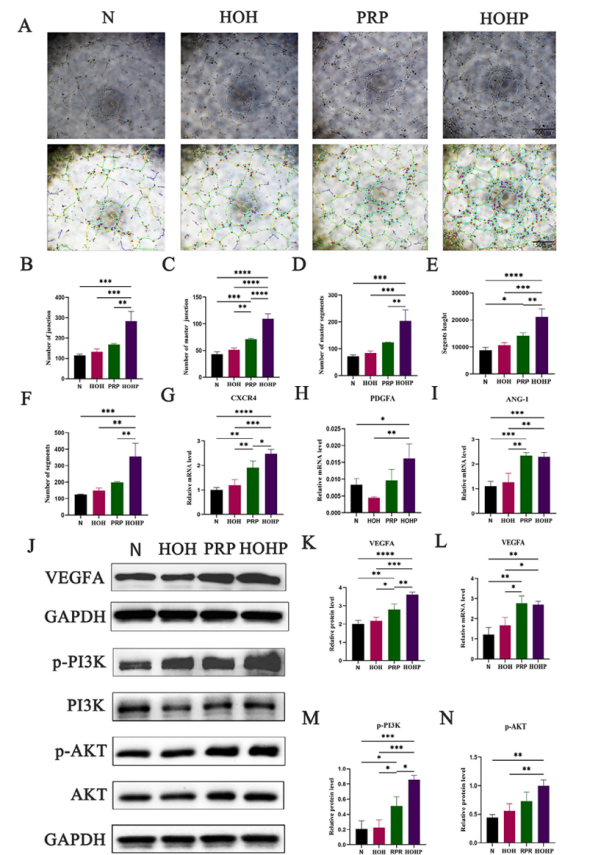
图3 HOHP对体外HUVEC血管形成的影响
2.4大鼠子宫内膜损伤修复效果
SD大鼠子宫损伤模型结果显示HOHP组子宫内膜厚度恢复至461 μm(接近正常组N的471 μm,IU组仅326 μm),腺体数量相较于IU损伤组显著增加(图4B-D),HOH组和PRP组效果有限(厚度361 μm和373 μm)。
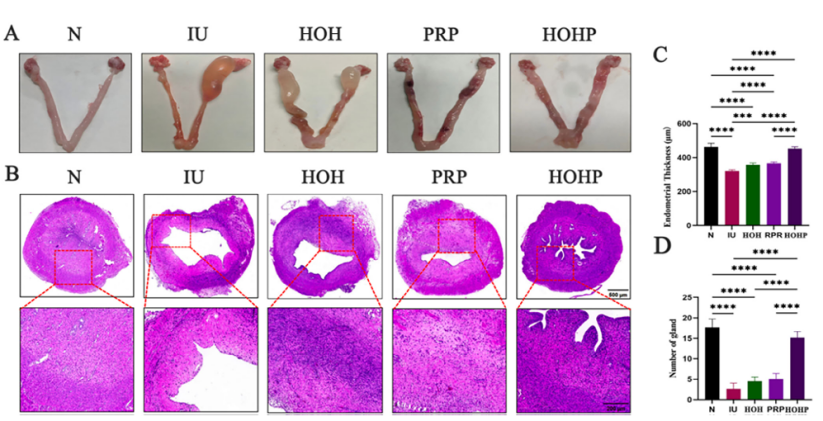
图4 HOHP 对恢复子宫内膜厚度和腺体数量的体内影响
2.5子宫内膜纤维化抑制
胶原沉积实验结果显示,IU组胶原沉积率达51.33%(正常组6%),HOHP组降至11%(图5A-B)。纤维化标志物α-SMA免疫组化阳性区域减少,Western blot和RT-PCR显示TGF-β1和α-SMA表达显著下调(图5C-J)。Ki67染色证实HOHP组细胞增殖活跃(图5E-F)。
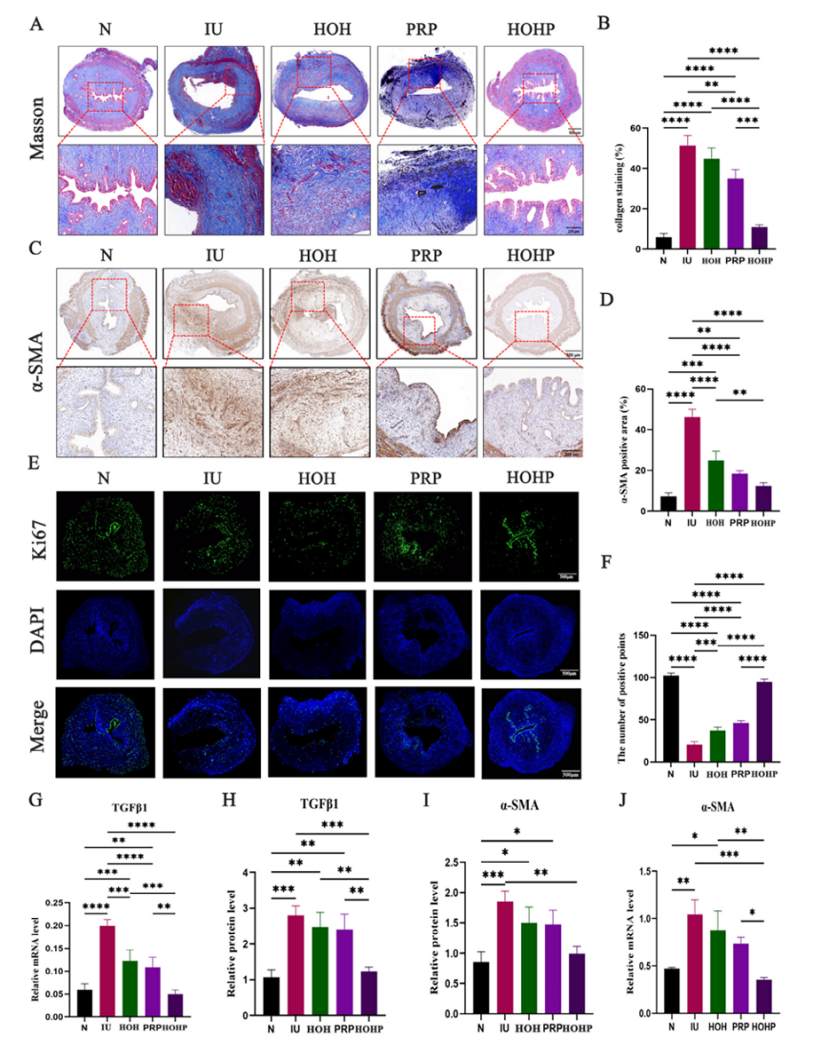
图5 HOHP 对子宫内膜胶原沉积的体内影响
2.6在体内促进子宫内膜血管生成
血管新生免疫组化结果显示HOHP组VEGFA阳性区域达28.7%(图6A,D)。CD31免疫荧光证实微血管网络形成增强(图6B,F)。Western blot和RT-PCR显示VEGFA蛋白和ANG-1 mRNA表达接近正常水平(图6F-G)。
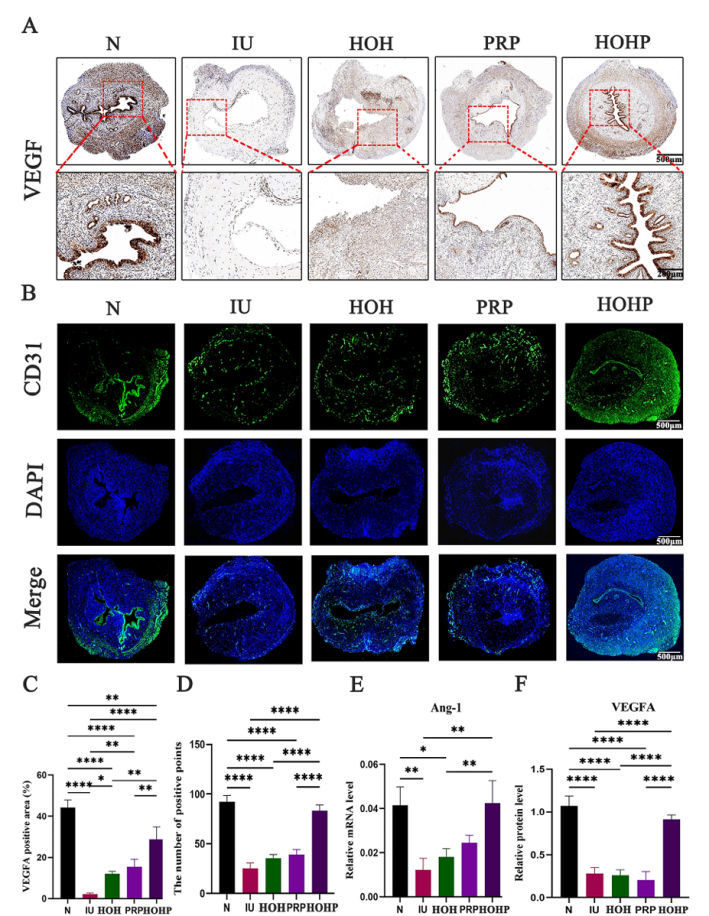
图6 HOHP 在体内子宫内膜血管生成中的作用
2.7修复机制深入验证
在提升容受性方面,RT-PCR和Western blot结果显示HOHP上调容受性标志物VIM、ITG-β3和CK-19(图7A-B,E-F,H-I)。在炎症抑制方面,结果显示IL-1β mRNA和NF-κB蛋白表达显著降低(图7D,G,J),纤维化积累减少。PI3K/AKT通路激活,体内实验证实p-PI3K和p-AKT水平升高(图7K-M),促进血管新生和细胞迁移。
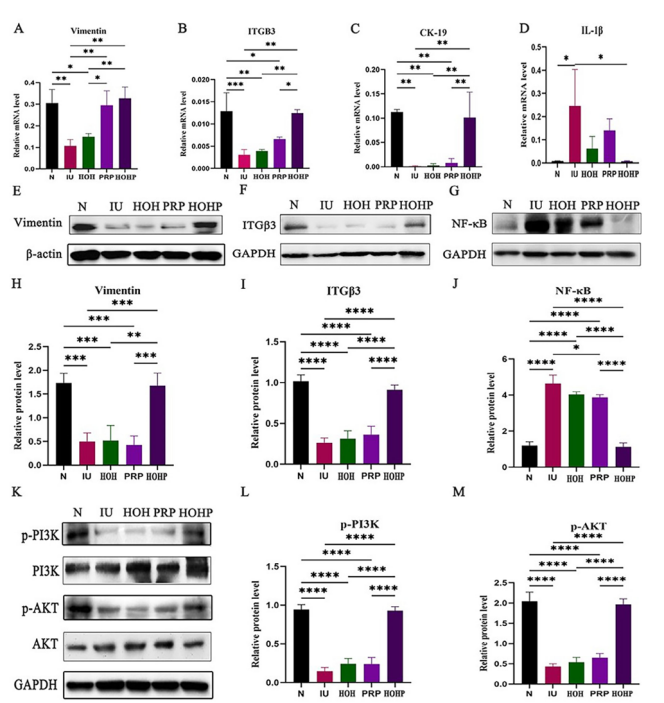
图7 HOHP 通过旁分泌 VEGF 激活 PI3K/AKT 通路和其他相关分子来促进子宫内膜修复
2.8生育功能恢复验证
胚胎植入实验结果显示HOHP组平均胚胎数11个(接近N组15个),PRP组仅5-11个,HOHP组和IU组无植入(图8A)。幼鼠存活实验结果显示HOHP组生育率73.3%,幼鼠存活率100%,PRP组仅46.7%,存活率85.71%。幼鼠体重正常,无异常(图8D-F)。
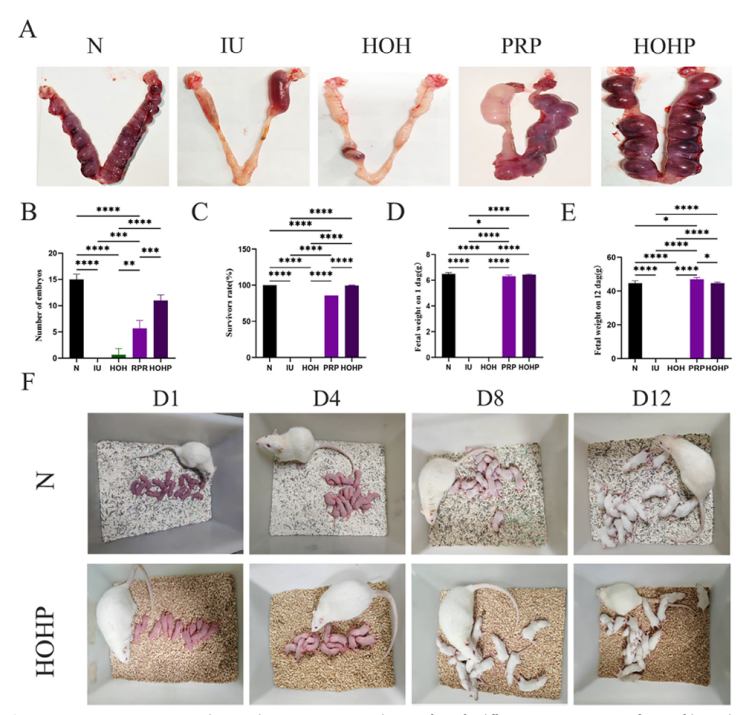
图8 子宫损伤大鼠的妊娠结局
3. 主要结论
本研究制备了具有良好生物相容性、注射性、自愈性、组织粘附的HOHP,能够适应子宫内复杂的物理和生理环境,提升 PRP 负载和缓释能力。研究结果表明,HOHP通过缓释PRP激活PI3K/AKT通路,上调VEGFA从而显著促进血管新生、减少胶原沉积、抑制纤维化、恢复子宫内膜结构促进厚度和腺体增加,并最终实现生育功能恢复。该研究为子宫内膜损伤性不孕提供安全、高效的治疗策略,具备临床转化潜力。
4. 文献来源
Zhang Q, Qin D, Liu C, et al. Injectable hydrogel loaded with plasma-rich platelets repairing endometrial injury and remodeling reproductive function by regulating PI3K/AKT pathway. Small. 2025;41(18):2412177. doi:10.1002/smll.202412177