基于血小板衍生物的再生治疗策略在神经修复、子宫内膜再生
及辅助生殖中的潜力与挑战
天津医科大学总医院输血科 供稿
引言
近年来,血小板衍生生物活性成分在再生医学中的应用备受关注。研究表明,血小板细胞外囊泡(PEVs)具有神经保护、抗炎及促进再生的功能,在创伤性脑损伤和帕金森病模型中展现出治疗潜力;而基于可注射水凝胶负载富血小板血浆(PRP)的系统,则能够通过缓释生长因子有效修复子宫内膜损伤,恢复生育功能。此外,PRP在辅助生殖领域也被探索用于改善卵巢低反应患者的获卵数,但其对胚胎质量与妊娠结局的效益尚存争议。我们梳理了近期发表在《Journal of biomedical science》、《Small》、《Human Reproduction》等期刊的文章,这些研究共同凸显了血小板衍生物作为一种多效性再生治疗策略的潜力与挑战。
人类血小板浓缩上清中的细胞外囊泡在创伤性脑损伤和帕金森病模型中的神经保护效果
编译:周令怡
审校:杜春红,单永强
一、研究背景
近年来,人血小板裂解物(HPLs)因其富含多种生物活性成分,在中枢神经系统疾病治疗中显示出促进神经修复的潜力。血小板细胞外囊泡(PEVs)作为血小板释放的纳米级囊泡,携带神经营养因子、mRNA、miRNA等生物活性分子,在神经保护与再生中具有重要作用,但其在创伤性脑损伤(TBI)和帕金森病(PD)中的机制尚不明确。本研究首次从临床级血小板浓缩物(PC)上清中分离PEVs,通过系统实验验证其神经保护作用及机制。
二、主要结果
2.1 研究通过动态光散射、纳米颗粒追踪及冷冻电镜等技术成功分离出PEVs,其粒径主要分布于50–350 nm,平均约200 nm,具有典型脂质双层结构。蛋白质组学分析鉴定出652种蛋白质,其中98%与Vesiclepedia数据库匹配,包括BDNF、VEGF、PDGF-AB等神经营养因子,SOD1/2等抗氧化剂,以及CD41、CD62P等血小板标志蛋白。凝血活性分析显示PEVs磷脂酰丝氨酸表达较低,凝血时间延长至14秒,表明其促凝风险较低。见图1。
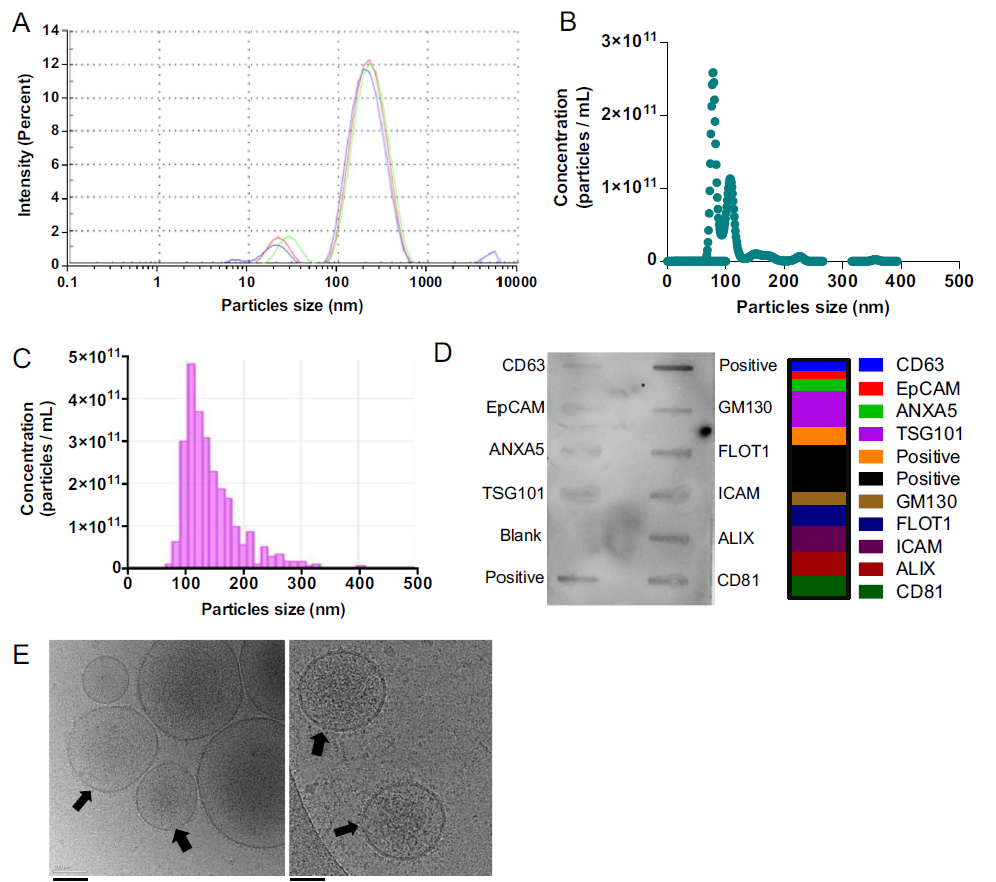
图1 PEVs的生物物理特性分析
A. 通过动态光散射(DLS)技术确定的PEVs大小分布图, 其中主峰大约在200纳米左右。B. 通过可调电阻脉冲传感(TRPS)技术确定的PEVs数量和大小分布图。C. 通过纳米粒子跟踪分析(NTA)技术确定的PEVs数量和大小分布图。D. 人类特异性抗体阵列与PEVs孵育后的图像,评估EVs标记物TSG101、ALIX、CD81、FLOT1、CD63和ANXA5的表达。E. 代表性的冷冻电子显微镜(Cryo-EM)图像显示PEVs的脂质双层膜,箭头指示了脂质双层的存在。尺度条表示100纳米。
2.2 体外实验显示,PEVs预处理可显著抑制erastin诱导的LUHMES多巴胺能神经元铁死亡,使细胞存活率从17%提高至71%。在SH-SY5Y细胞中,PEVs促进β-III微管蛋白表达(荧光强度增强2.5倍)和神经突生长,其效果与阳性对照相当。划痕实验表明PEVs可显著加速伤口愈合。在BV-2小胶质细胞中,PEVs抑制LPS诱导的TNF-α、IL-6和IL-1β的表达,且未激活静息小胶质细胞。见图2。
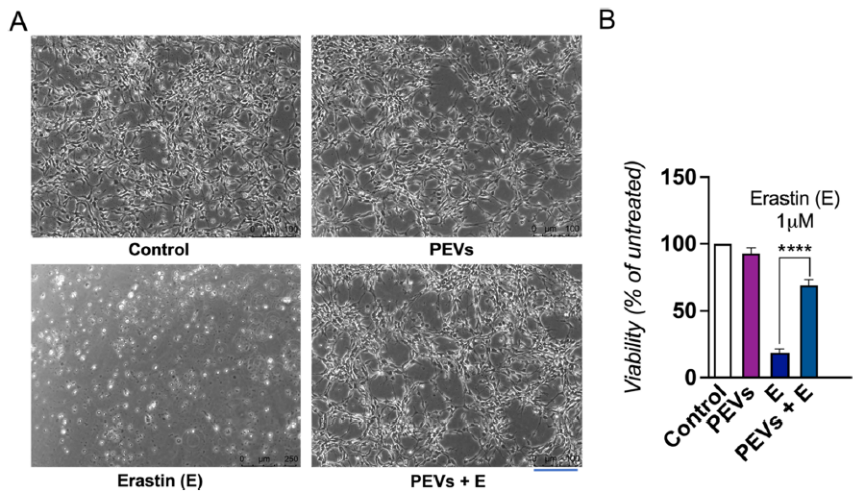
图2 PEVs对LUHMES细胞暴露于erastin神经毒素后的活性影响
A. LUHMES细胞经PEVs处理后,随后添加1 μM神经毒素erastin。图像显示了24小时后的细胞形态,比较了erastin处理和PEVs处理的细胞形态差异。B. 通过CCK-8实验量化了LUHMES细胞在24小时后的活性,展示了erastin和PEVs处理对细胞活性的影响。
2.3 体内实验中,鼻内给予PEVs可有效穿透血脑屏障,分布于大脑皮层、海马及丘脑等区域。在TBI模型中,PEVs处理降低皮质区炎症因子(TNF-α、GFAP、Cd68、Trem2)表达。在MPTP诱导的PD模型中,PEVs使黑质区TH阳性细胞数量增加1.8倍,并改善小鼠运动功能。见图3。
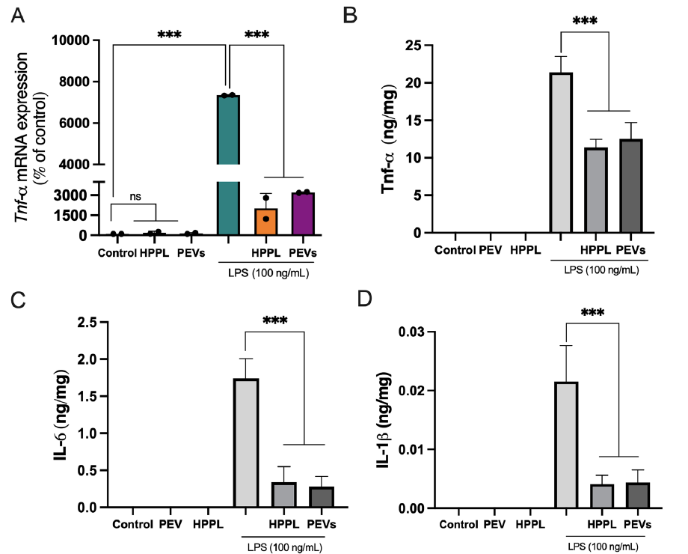
图3 展示了PEVs对激活的BV-2小胶质细胞的抗炎活性
A. LPS被用来诱导BV-2细胞的激活,1小时后添加PEVs和HPPL(用作非炎症对照)处理后的TNF-α基因表达水平。B-D. 通过ELISA定量细胞上清液中TNF-α、IL-6和IL-1β的蛋白表达水平。
2.4 蛋白质组比较显示PEVs与HPLs的蛋白组成高度相似(重叠率达90%),其功能涉及抗氧化、抗炎和神经再生等多通路协同作用。研究表明,PEVs具有低免疫原性、高稳定性及良好的血脑屏障穿透能力,展现出良好的临床转化前景。见图4。
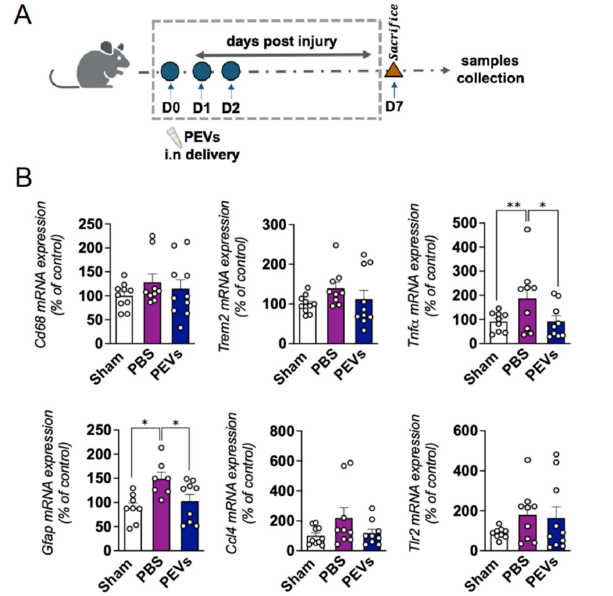
图4 A. 示意图说明了CCI-TBI小鼠模型用于评估PEVs治疗的抗炎效果,包括CCI手术和PEVs的给药方案。给药途径:鼻内注射(i.n.)。PEVs剂量:每次60 μL(含1.2×10^8颗粒),连续给药3天,总剂量180 μL。对照组:给予等体积PBS。B. 展示了PEVs处理对受伤后炎症标记物表达的影响,包括Gfap、Cd68、Trem2、Ccl4、Tlr2和Tnf-α基因的表达变化。
三、主要结论
本研究通过多维度实验揭示,临床级血小板浓缩物来源的PEVs具有显著的神经保护、抗炎及促修复效果,且鼻内给药可有效递送至脑部区域,为神经退行性疾病的生物治疗提供了新策略,并推动血小板衍生产物在神经再生医学中的应用。
四、文献来源
Delila, L.,Nebie, O.,Le, N. T. N., et al. Neuroprotective effects of intranasal extracellular vesicles from human platelet concentrates supernatants in traumatic brain injury and Parkinson's disease models. Journal of biomedical science. 2024 Sep 5;31(1):87. doi: 10.1186/s12929-024-01072-z.
基于可注射水凝胶负载富血小板血浆修复子宫内膜损伤并恢复生育力的研究
编译:李梅
审校:杜春红,单永强
一、研究背景
富血小板血浆(PRP)富含多种生长因子,已广泛应用于骨关节炎和脱发等领域,近年来其在子宫损伤修复治疗中的应用日益增多。子宫内膜修复是一个复杂过程,需要血管再生、细胞增殖、胶原沉积及伤口愈合等多方面协同作用,而PRP所含的多种生长因子恰好可共同参与这一过程。然而,单纯注射PRP存在生长因子快速释放、易被清除等问题,可能导致局部有效浓度不足,修复效果受限;传统水凝胶也难以适应子宫损伤形态多样化的修复需求。为此,本研究旨在开发一种新型组织特异性可注射水凝胶系统,该水凝胶源自天然聚合物,能够有效负载并缓释PRP中的活性成分,为子宫内膜损伤修复及生育功能恢复提供新策略。
二、主要结果
2.1本研究成功制备了负载PRP的HBC-ODA水凝胶(简称HOHP)。该水凝胶具有多孔蜂窝状微观结构,能在60秒内实现结构自愈合,展现出良好的可注射性和组织黏附性。体外降解实验表明,HOHP在21天内可完全降解且无残留。其缓释特性能够有效保护PRP中活性成分,实现生长因子的持续释放。见图1。
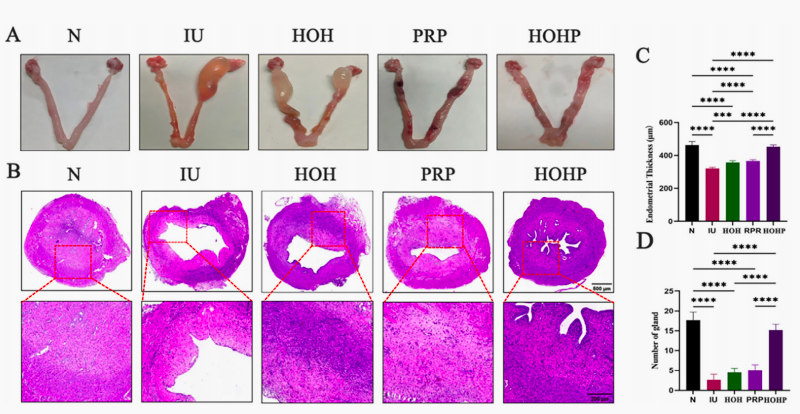
图1. HOHP对恢复子宫内膜厚度及腺体数量的体内效应。A. 术后第21天大鼠离体子宫不同处理组代表性图像;B. 大鼠子宫组织结构H&E染色图像;C. 各组子宫内膜厚度定量分析;D. 各组腺体数量定量分析。
2.2 在体外实验中,采用石川细胞(模拟子宫内膜上皮细胞)和人脐静脉内皮细胞(HUVECs)进行评价。CCK-8实验和Transwell迁移实验结果显示,HOHP无细胞毒性,并可显著促进两种细胞的增殖和迁移。对HUVECs的成管实验进一步表明,HOHP处理可明显促进血管生成,并上调VEGFA、PI3K和AKT等相关基因和蛋白的表达。见图2。
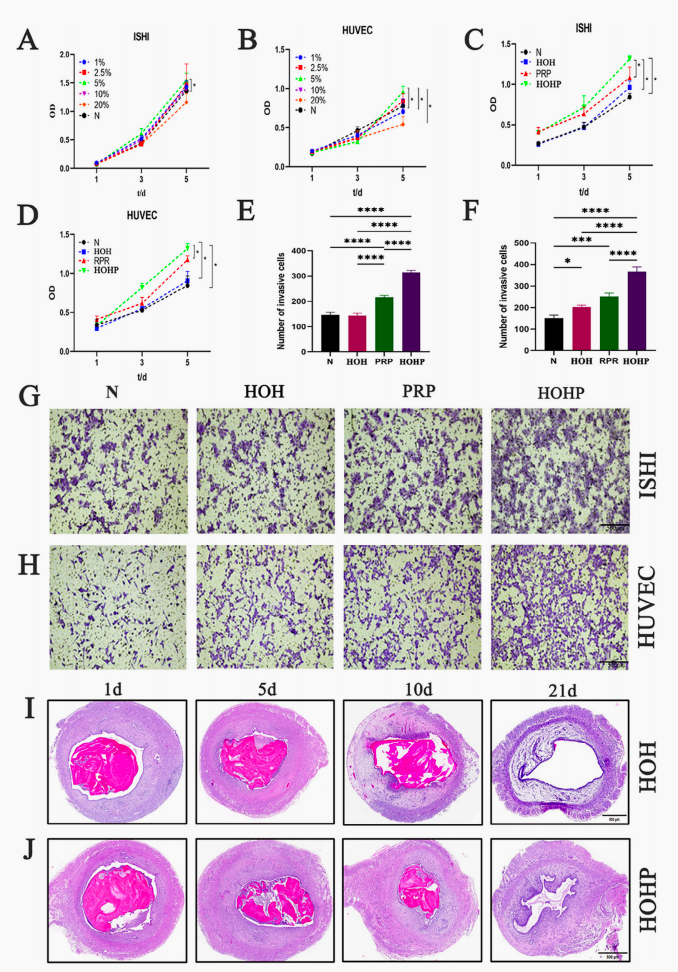
图2.水凝胶的体外细胞相容性与体内降解性能。A-B. 不同浓度PRP对石川细胞和人脐静脉内皮细胞(Ishikawa和HUVECs)增殖的影响;C-D.通过CCK-8检测试剂盒分别在培养第1天、第3天和第5天检测与水分子、PRP及HOHP条件培养基共培养的Ishikawa和HUVECs的增殖情况;E-H. 细胞迁移染色及其定量分析;I-J.水凝胶体内降解实验。各组均进行三次独立实验,数据以均值±标准差表示,p值采用单因素方差分析计算。*p < 0.05, ***p < 0.001, ****p < 0.0001.
2.3 在体内实验中,采用95%乙醇损伤雌性SD大鼠子宫内膜模型,评估HOHP的修复效果。组织学分析显示,HOHP处理能显著增加子宫内膜厚度和腺体数量,促进组织形态恢复。Masson染色和α-SMA免疫组化结果显示,HOHP组胶原沉积和纤维化程度显著减轻,同时细胞增殖标志物Ki67阳性细胞数明显增多,表明子宫内膜处于活跃再生状态。见图3。
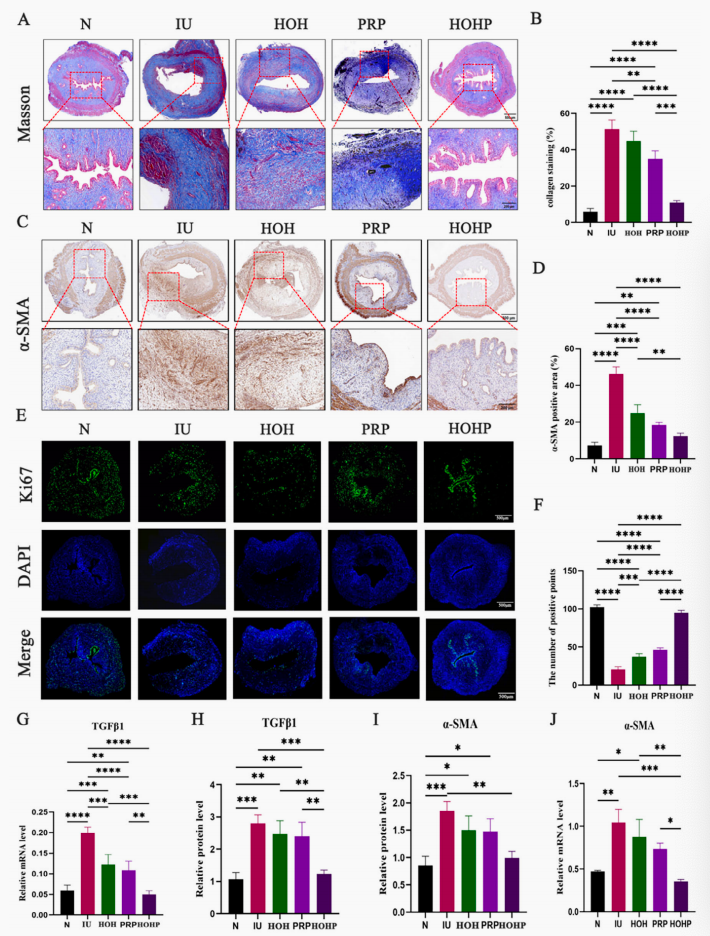
图3. HOHP对子宫内膜胶原沉积的体内效应。A. 采用马松染色法评估子宫内膜纤维化情况:染色组织切片中观察到的蓝色区域表示瘢痕形成;B. 纤维化面积比值的定量分析;C-D代表性免疫组化染色图像及α-平滑肌肌动蛋白(作为纤维化标志物)的定量分析;E-F. 免疫荧光染色及Ki67(细胞增殖标志物)的定量分析;G. TGFβ1蛋白质印迹法的统计学结果;H. 以GAPDH为内参的TGFβ1 mRNA表达量;I. α-平滑肌肌动蛋白蛋白质印迹法统计结果;J. 以GAPDH为内参的α-平滑肌肌动蛋白mRNA表达量。
2.4 在分子机制方面,HOHP处理上调了血管生成相关标志物(VEGFA、CD31和ANG-1)的表达,促进损伤区微血管网络形成。此外,波形蛋白(VIM)、整合素β3(ITG-β3)和细胞角蛋白(CK-19)等子宫内膜容受性相关标志物表达也显著提高,而炎症因子IL-1β和NF-κB表达下降。Western blot结果显示,HOHP通过激活VEGF介导的PI3K/AKT信号通路发挥修复作用。见图4。
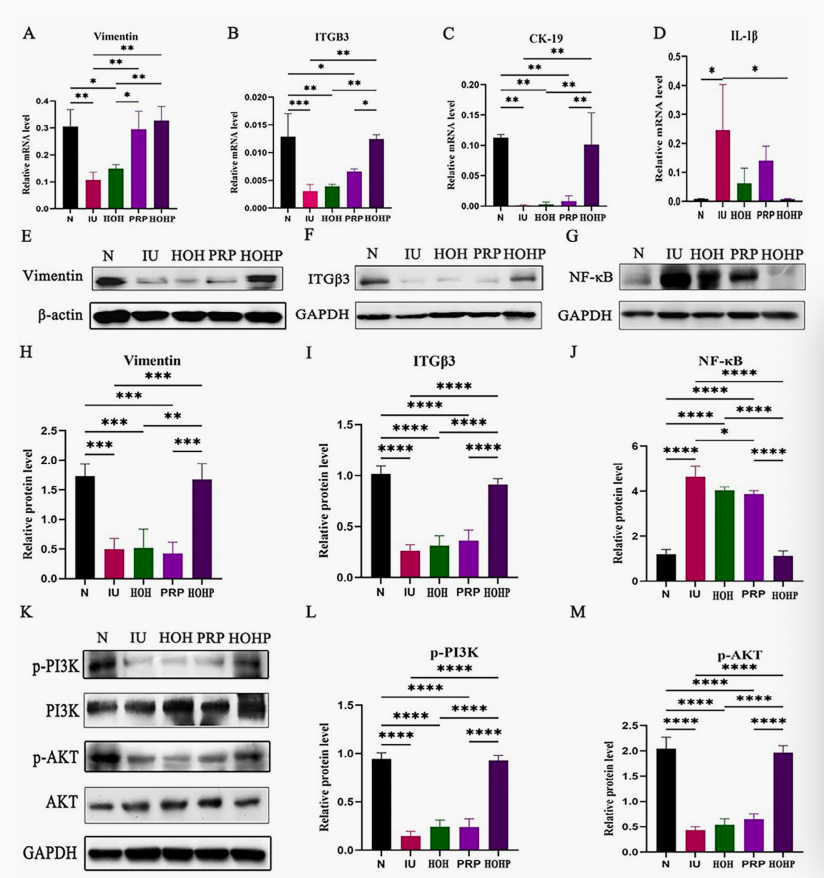
图4. HOHP通过旁分泌VEGF激活PI3K/AKT通路及相关分子促进子宫内膜修复。A. VIM mRNA表达量;B. 与子宫内膜耐受性相关基因的ITG-β3 mRNA表达量;C. CK-19 mRNA表达量;D. IL-1β mRNA表达量(D);E,H. VIM蛋白的代表性western印迹图像及统计结果;F,I. ITG-β3蛋白的代表性western印迹图像及统计结果;G,M. NF-κB的代表性蛋白质印迹图像及统计结果;K. p-PI3K、PI3K、p-AKT和AKT表达量的蛋白质印迹分析;L-M. 以GAPDH为标准化对照的p-PI3K和p-AKT表达量统计。
最终,生育力恢复实验表明,经HOHP治疗的大鼠平均胚胎数量接近正常对照组,幼鼠存活率显著提高,证实其能有效恢复损伤后的子宫生育功能。
三、主要结论
本研究研发了一种新型水凝胶,搭载PRP原位注射,通过缓慢释放生长因子,激活血管内皮生长因子(VEGF)介导的PI3K-AKT信号通路,将受损伤的子宫内膜,通过细胞增殖、血管再生、抗纤维化等,起到修复和再生的作用,进而恢复其生育力。本研究不仅构建了兼具缓释、粘附、可降解功能的HOHP,还揭示了PRP进行子宫内膜修复和生育力恢复的作用机制,为临床和科研提供新的方向与思路。
四 文献来源
Qing Zhang, Di Qin, Chengyang Liu, et al. Injectable Hydrogel Loaded with Plasma-Rich Platelets Repairing Endometrial Injury and Remodeling Reproductive Function by Regulating PI3K/AKT Pathway. J Small. 2025 May; 21(20):e2412177. doi: 10.1002/smll.202412177. Epub 2025 Apr 1.
卵巢内PRP注射对卵巢低反应患者体外受精结局的影响:一项随机双盲对照
实验
编译:郝金童
审校:杜春红,单永强
一、研究背景
卵巢低反应(poor ovarian response,POR)患者是辅助生殖领域的主要挑战之一,传统卵巢刺激方案效果有限。因富血小板血浆(PRP)含多种生长因子,近年来,卵巢内注射PRP被提出作为一种潜在改善卵巢反应的治疗手段,但其疗效存在争议。本研究旨在通过一项双盲随机对照试验,评估PRP注射对POR患者连续取卵周期中获卵数、囊胚发育及妊娠结局的影响。
二、主要结果
2.1 获卵数评估:本研究中,将60名POR患者随机分为两组,均进行了连续三次卵巢刺激以积累卵母细胞,并在每次取卵时对双侧卵巢进行了PRP或安慰剂注射治疗。在三个取卵周期中,PRP组累计获取的成熟卵母细胞数略高于对照组。所有患者的成熟卵母细胞数在连续取卵周期中均呈现递增趋势,但PRP组增幅更大。PRP注射显示出对POR患者获取成熟卵母细胞数的积极作用。见图1。

图1.PRP卵巢注射对三次取卵周期中获卵数影响。A.两组间每周期穿刺卵泡数;B.两组间取到的卵细胞数;C.两组间取到的成熟卵细胞数,PRP组累计获取成熟卵母细胞数(10.45±0.41)显著高于对照组(8.91±0.39)(P=0.008);D.两组间每个周期取到的成熟卵细胞数的变化趋势,从P1的2.55增加到P3的5.27;其中,第3次取卵时,PRP组成熟卵子数(5.27±0.73)vs 对照组(4.15±0.45)(P=0.029)。取卵间隔时间(±SEM)分别为24.32±1.58天、25.92±1.69天和49.38±2.38天,未发现卵母细胞数量(总卵母细胞或成熟卵母细胞)的差异取决于两次取卵的间隔。
2.2 囊胚发育及妊娠结局比较:在第三次取卵后,对患者行卵胞浆内单精子注射(ICSI)及胚胎植入前染色体筛查(PGT-A)。每例患者随访至分娩。PRP组相较于对照组,整倍体囊胚率及平均整倍体囊胚数无明显差异,而临床妊娠率有所下降。即PRP治疗对胚胎质量及妊娠率均无明显改善。由于只进行了单胚胎移植(sET),因此没有出现多胎妊娠。意向治疗(ITT)分析显示总体妊娠率为43%(60名患者中26人成功)。尽管对照组的足月妊娠率较高,但两组之间无统计学显著差异。在分娩方式和新生儿性别方面,对照组与治疗组亦无统计学显著差异。见图2。
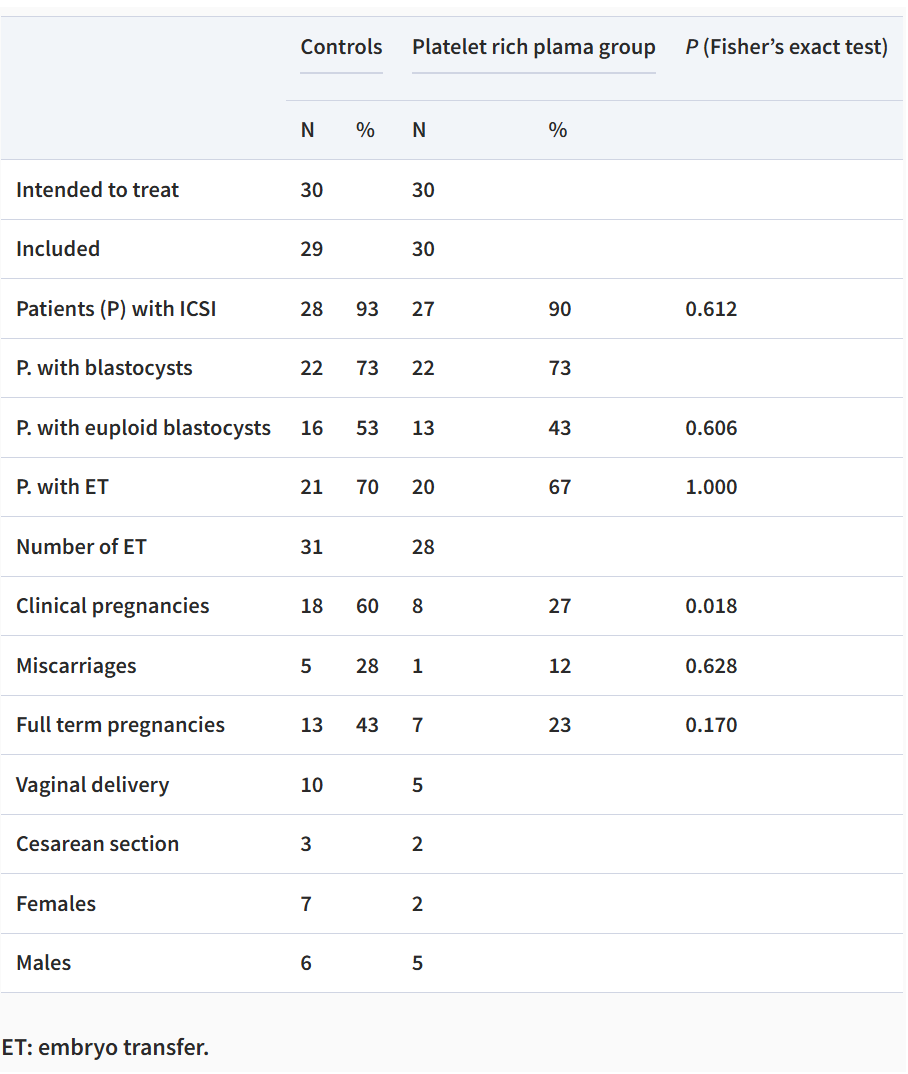
图2.PRP干预的临床结局。整倍体囊胚率:PRP组43.33% vs 对照组53.33%(P=0.606);平均整倍体囊胚数:两组均为0.81(P=1.000);临床妊娠率下降:PRP组临床妊娠率(27%)显著低于对照组(60%)(P=0.018)。
三、主要结论
在本临床试验中,PRP卵巢注射可提高POR患者连续取卵周期所获得的成熟卵母细胞数量,但无明显改善胚胎整倍性及囊胚质量。临床妊娠率在PRP组反而降低,提示PRP可能影响了子宫内膜容受性或卵母细胞发育潜能。观察到的获卵数增加可能源于穿刺操作的机械效应(对照组亦有提升),而非PRP的生物活性成分。因此,应谨慎将此类干预效果称为“卵巢再生”,更宜称为“卵泡激活”。PRP在生殖医学中的应用仍需进一步的机制研究和标准化方案。
四、文献来源
Barrenetxea, G., Celis, R., Barrenetxea, J., Martinez, E., De Las Heras, M., Gómez, O., & Aguirre, O. (2024). Intraovarian platelet-rich plasma injection and IVF outcomes in patients with poor ovarian response: a double-blind randomized controlled trial. Human Reproduction, 39(4), 760–769.doi: 10.1093/humrep/deae038.