血小板与红细胞相互调节及其预防血栓形成的调控机制
中国输血协会临床输血管理学专业委员会组稿
深圳市第二人民医院输血科组织编译
引 言
红细胞和血小板是血液中两种重要的细胞成分,它们各自承担着不同的生理功能,红细胞负责运输氧气和二氧化碳,而血小板负责止血和免疫调节,保持这两种细胞的健康对维持人体正常的生理功能至关重要。此外,红细胞与血小板之间相互调节以及红细胞和血小板可通过直接或间接方式参与其它细胞的免疫调节过程,细胞间调节失衡可导致疾病发生。因此,研究红细胞、血小板和凝血与血栓之间相互作用的潜在机制具有重要意义。
近年,针对血小板与红细胞之间调节的机制以及血小板功能异常在血栓形成与炎症反应中的作用研究取得一定新进展:血小板在结合和清除衰老红细胞中起着关键作用,当血小板数量严重不足或脾脏功能缺失时,可导致衰老红细胞在循环中异常积累,这些滞留的衰老红细胞因促凝血活性升高,成为血栓形成的重要诱因。但红细胞输注可改善出血时间,然而在不同血小板计数水平下,尤其是在重度血小板减少症的情况下,红细胞对止血的影响仍然不明确。脓毒症(Sepsis)是一种由全身性感染引起的系统性炎症反应,常导致多器官功能障碍和高死亡率,脓毒症患者常并发血栓形成和凝血障碍,目前对脓毒症血栓患者血小板信号通路的研究与靶向治疗仍不充分。因此,本期将介绍血小板通过形成吞噬前的血小板-红细胞复合物介导衰老红细胞的清除、红细胞通过生物物理和生化手段在剪切条件下调节血小板功能和止血以及血小板中STING(Stimulator of Interferon Genes)通过增强血小板激活和颗粒分泌加剧败血症血栓形成的研究,为维持血液稳态和血栓的预防与治疗提供新思路和新策略。
1、 血小板通过形成吞噬前的血小板-红细胞复合物介导衰老红细胞的清除。
编译:叶至顺,袁咏梅 审校:伍昌林
研究背景:
在正常人体血液循环中约0.1%~0.3%的红细胞以血小板-红细胞复合物形式存在,但在镰刀细胞贫血、疟疾等红细胞损伤性疾病中,P-RBC复合物水平显著升高并参与病理过程,例如通过促进血栓形成或介导病原体清除。然而,健康状态下这些复合物的生理作用尚不清楚,随着红细胞的衰老,其红细胞会表现出与镰状细胞病和疟疾中血小板结合的红细胞相似的生理和分子变化,基于此,研究者提出假设:血小板可能通过结合衰老红细胞形成P-RBC复合物,进而标记并促进其清除,从而维持血液稳态。
主要研究结果:
1. P-RBC复合物与衰老红细胞的结合
实验设计:通过脉冲追踪标记技术(pulse-chase labeling),向小鼠注射NHS-生物素或CFSE标记循环红细胞,随后动态分析不同年龄段红细胞的P-RBC复合物比例。研究结果:衰老红细胞(58-60天)的P-RBC复合物比例是年轻红细胞的10倍(P< 0.0001);衰老红细胞表面PS和Fas受体(FasR)表达显著升高,且复合物中这些标志物水平更高(P<0.0001),提示其介导血小板结合(图1)。
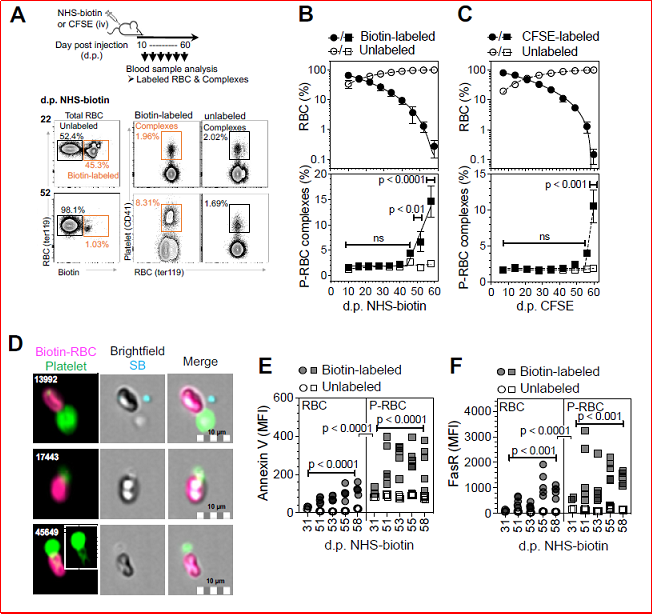
图1、老化红细胞中P-RBC复合物的鉴定和表征
2. P-RBC复合物依赖脾脏快速清除
实验设计:将体外标记的P-RBC复合物输注至小鼠,追踪其清除速率,分析脾切除患者及健康对照的血液样本。研究结果:P-RBC复合物的清除速率是游离红细胞的7倍(P<0.0001),且依赖吞噬细胞(图2C,氯膦酸盐处理使清除率降低5倍);脾切除患者术后60天P-RBC复合物水平升高21.5倍(P<0.001),证明脾脏是清除器官(图2)。
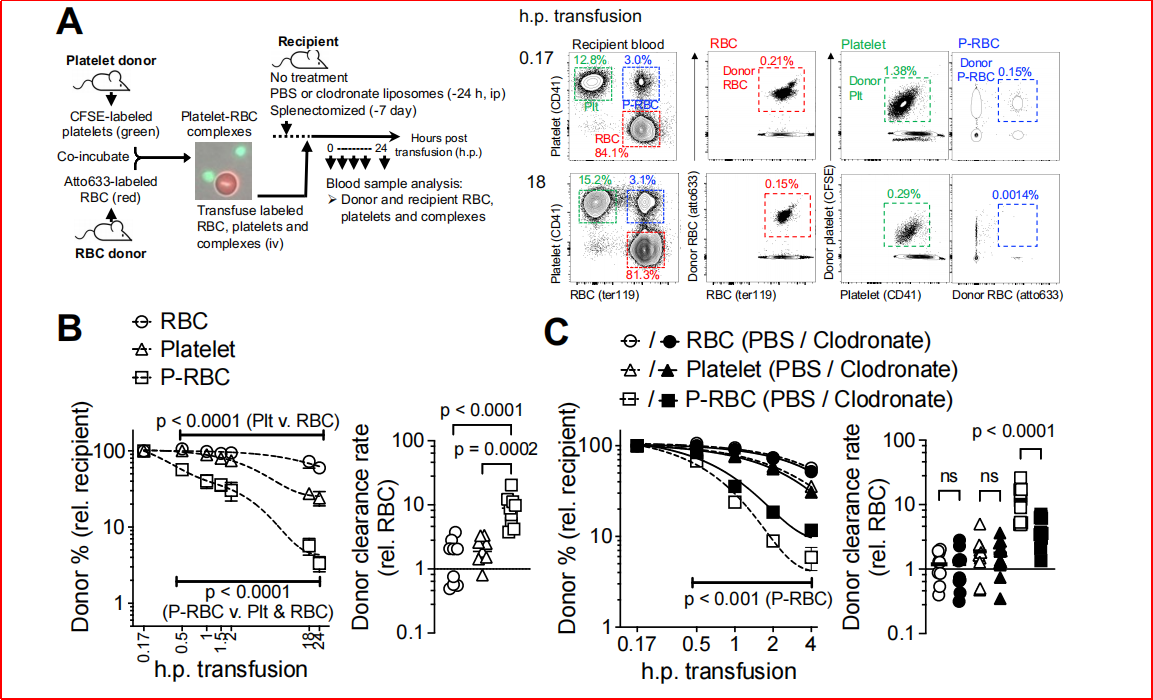
图2、P-RBC复合物从血液中清除的特征
3.P-RBC复合物吞噬作用的特征
实验设计:小鼠输注PKH26标记的(供体)红细胞和血小板标记抗体(抗-GPIb-DyLight649,X649)。在输血2或20小时后收获单细胞肝和脾制剂使用所描述的方法,通过流式细胞术进行染色和分析。研究结果:脾脏红髓巨噬细胞(RPM)中,20%-22%的吞噬细胞摄入P-RBC复合物(显著高于肝脏),免疫荧光显示巨噬细胞同时吞噬红细胞和血小板(图3)。

图3、P-RBC复合物吞噬作用的特征
4. 血小板减少导致衰老红细胞清除障碍
实验设计:通过抗体耗竭小鼠血小板或使用Mpl-/-(血小板数量为正常10%)模型,分析红细胞清除效率,检测ITP患者血液样本。抗体耗竭血小板后,P-RBC复合物减少90%,衰老红细胞滞留(P< 0.001),清除速率下降3.4倍;Mpl-/-小鼠复合物水平为野生型的50%,但红细胞清除未受影响,表明仅严重血小板减少破坏稳态;ITP患者P-RBC复合物减少,衰老标志物(PS、FasR)显著升高(P<0.05)(图4)。
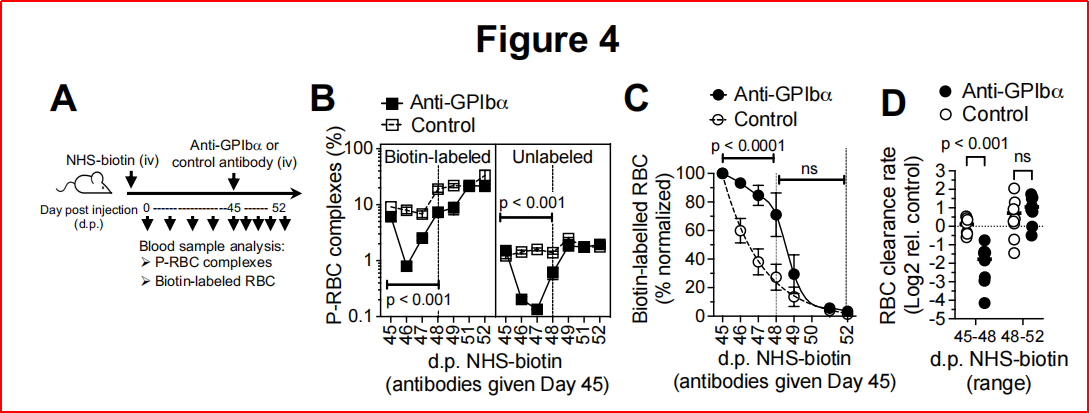
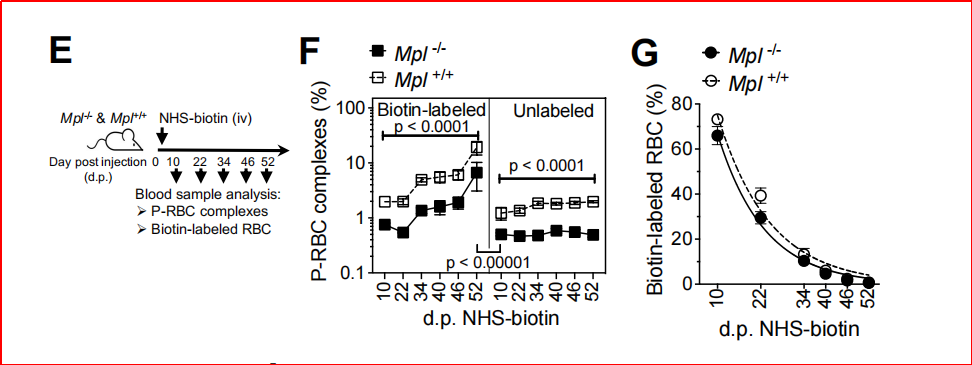
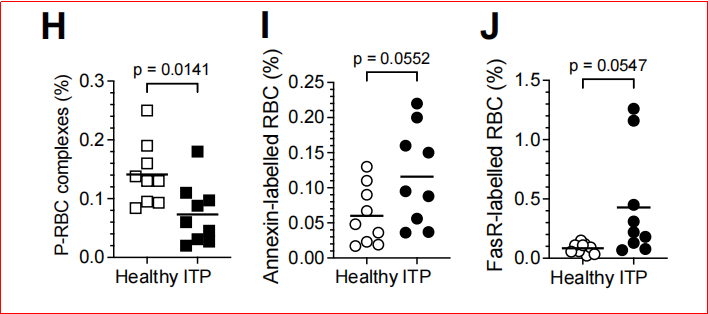
图4、血小板耗竭对循环中衰老红细胞滞留的影响。
主要结论:
1、 血小板在结合和清除衰老红细胞中起着关键作用:通过识别衰老红细胞表面暴露的磷脂酰丝氨酸(PS)和Fas受体等分子标志物,血小板与衰老红细胞形成P-RBC复合物。这些复合物通过脾脏红髓巨噬细胞的吞噬作用及机械过滤作用被高效清除。当血小板数量严重不足或脾脏功能缺失时,P-RBC复合物的生成或清除受阻,导致衰老红细胞在循环中异常积累。这些滞留衰老细胞因促凝血活性升高,成为血栓形成的重要诱因,这解释了ITP患者和脾切除人群血栓风险升高的机制。
2、 轻度血小板减少可通过肝脏单核细胞等代偿机制维持红细胞清除稳态。该发现不仅完善了血小板在生理性红细胞更替中的功能,还为临床干预提供了新靶点—通过调节血小板-红细胞相互作用或靶向衰老标志物,可能改善血栓性疾病和红细胞代谢障碍的治疗策略。
文献来源:Dian C Ningtyas , Florentina Leitner, Huma Sohail ,et al. Platelets mediate the clearance of senescent red blood cells by forming prophagocytic platelet-cell complexes. Blood. 2024;143(6):535-547. doi: 10.1182/blood.2023021611.
2、 红细胞通过生物物理和生化手段在剪切条件下调节血小板功能和止血。
编译:李冠球,廖奇峰 审校:伍昌林
研究背景
红细胞(RBCs)可能在支持止血过程中发挥重要作用,红细胞计数较低与出血时间延长有关,而通过红细胞输注和纠正缺铁可以改善这种情况。以往的研究大多集中在红细胞的促血栓形成特性上,而对于止血过程的研究则相对较少,红细胞(RBCs)对止血的影响通常被认为与其血液流变学作用有关。研究表明,在贫血的动物模型以及同时患有贫血和血小板减少症的动物模型中,红细胞输注能够改善出血时间。然而,在不同血小板计数水平下,尤其是在重度血小板减少症的情况下,红细胞对止血的影响仍存在显著的知识空白。因此,该研究旨在通过确定红细胞在生理性和病理性剪切应力下对血小板聚集的贡献,以及阐明红细胞、血小板和凝血之间相互作用的潜在生物物理和生化机制,来填补这些关键的知识空白。
主要研究结果:
1.红细胞在流动条件下增强了血小板血栓的形成
将人血重新配制成不同红细胞压积(20%、30%和40%)与血小板计数(10×103/μL、50×103/μL、100×103/μL和300×103/μL)的比例,并在微流控腔室中以动脉壁剪切应力20 dyns/cm2进行灌流。腔室表面涂覆有胶原蛋白,这是内皮下基质的主要成分。在血小板计数为50×103/μL、100×103/μL和300×103/μL时,红细胞压积为30%时血小板血栓的覆盖面积显著大于20%(图1A-C)。然而,在血小板浓度为10×103/μL时,无论红细胞压积为20%、30%还是40%,形成的血小板血栓都非常少(图1D)。

图1、红细胞在流动条件下增强了血小板血栓的形成
2.红细胞对小鼠模型止血的影响
采用三种小鼠模型,通过分别改变红细胞压积和血小板计数,以及同时改变两者来表征红细胞对体内止血的影响。首先使用苯肼(PHZ)诱导溶血性贫血,PHZ通过氧化应激选择性地破坏成熟红细胞。研究结果:与对照组相比,PHZ使红细胞计数减少47.6%,红细胞压积降低45.5%(图2A)。这些小鼠的血小板计数(图2B)和网织血小板百分比增加(图2C),这与PHZ诱导的反应性血小板增多症一致。与对照小鼠相比,经PHZ处理的小鼠尾出血时间延长(图2D)。其次,小鼠被注入单克隆抗糖蛋白1bα(GP1bα)抗体,这种抗体能够增加抗体介导的血小板清除。这种处理并未改变红细胞压积(图2E),但使血小板计数减少了90%(图2F),并延长了尾出血时间(图2G)。相比之下,使用多克隆抗GP1bα抗体处理的小鼠,血小板计数减少了60%(图2F),但与对照组相比,出血时间的延长并未达到统计学上的显著性(图2G)。
模拟同时发生贫血和血小板减少症,对小鼠进行了亚致死剂量的全身照射,以模拟治疗诱导的全血细胞减少症。结果表明,在三种具有不同血小板-红细胞比例的小鼠模型中,红细胞促进了出血停止,并且即使在严重的全血细胞减少症条件下,红细胞输注也能增强局部凝血,形成富含纤维蛋白的凝块(图3)。
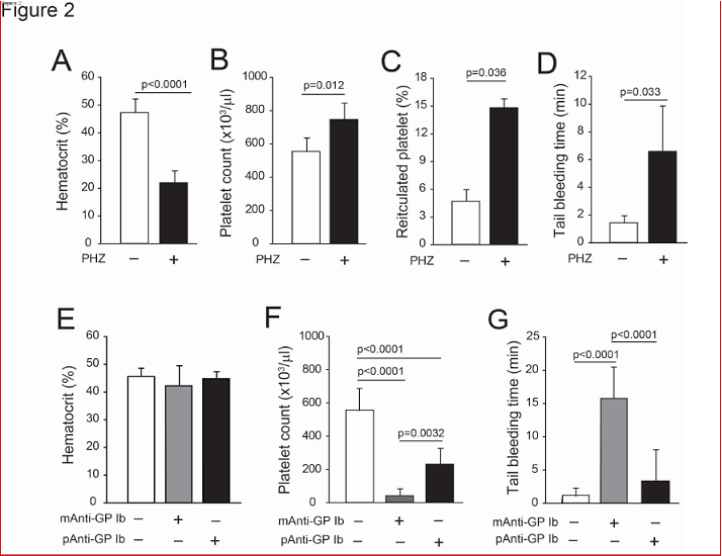
图2、红细胞和血小板浓度对尾部出血时间的影响
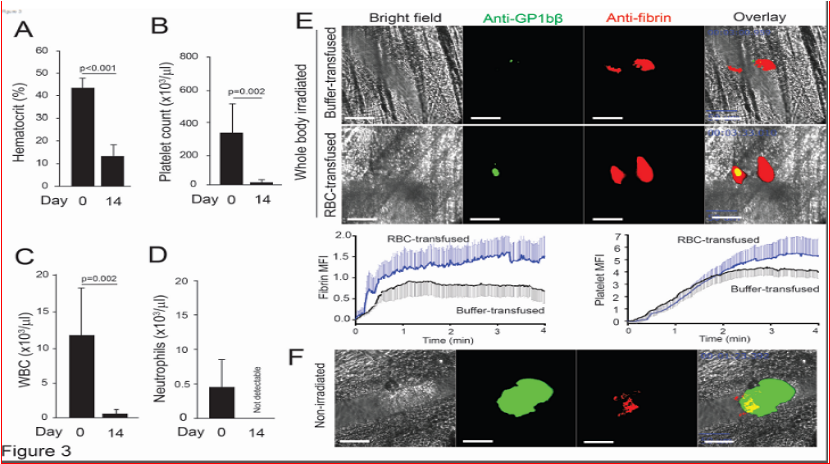
图3、激光引起的损伤部位止血
3.红细胞对剪切诱导的血小板聚集(SIPA)的影响
采用能够产生均匀的剪切应力的板流变仪,在4,000、6,000和10,000 s?1的剪切率下,有红细胞存在时的SIPA比没有红细胞时更高(图4A)。然而全血(WB)比富含血小板的血浆(PRP)更黏稠。尽管全血的黏度随着剪切率的增加而降低(也称为剪切变稀行为),但在测试的剪切率下,全血的黏度仍然比PRP更高,无论是在单独的剪切率下测试(图4B),还是在连续增加的剪切率下测试。在10 dyns/cm2到100 dyns/cm2的剪切应力范围内,全血中的SIPA相对于PRP显著增强(图4C),但在180 dyns/cm2时,全血和PRP中的SIPA被类似地诱导。在将全血暴露于53.9 dyns/cm2的剪切应力后,成像流式细胞术检测到5.65%的血小板与红细胞结合。这些结果表明,红细胞在溶液中促进了SIPA,且这一过程独立于血液黏度。
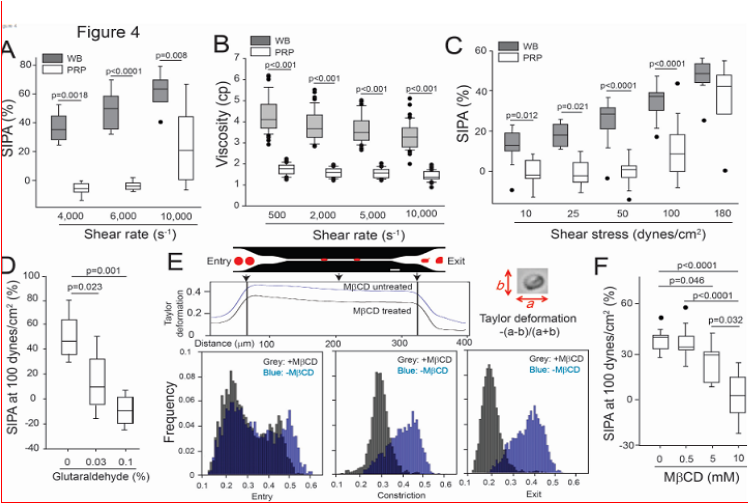
图4、SIPA的促进及其由膜胆固醇的调节
4.膜变形性及其对SIPA的影响
在4,000 s?1的剪切率下,含有新鲜、部分固定(用0.03%戊二醛处理5分钟)和完全固定(用0.1%戊二醛处理60分钟)的红细胞的重建血液中,SIPA逐渐降低(图4D)。我们使用甲基-β-环糊精(MβCD)来调节红细胞的变形性,MβCD可以在不固定细胞或影响细胞渗透压的情况下耗尽膜中的胆固醇。10 mM的MβCD能够耗尽超过90%的红细胞膜胆固醇。我们将红细胞在负压条件下通过微流控通道,并估算了泰勒变形(图4E)。在进入通道之前,未经处理和经MβCD处理的红细胞显示出相似的变形性指数。然而,一旦处于受限状态,经MβCD处理的红细胞的形状变化不如未经处理的红细胞明显,前者呈现出更接近圆形的形状,而后者则更为拉长,这表明MβCD处理增加了膜的刚性。在100 dynes/cm2的剪切应力下诱导的SIPA在MβCD处理的红细胞存在时以剂量依赖的方式降低(图4F)。
5.剪切诱导的红细胞释放ADP及其对血小板激活的启动效应
研究发现,红细胞在静息状态下并未释放可检测到的ADP,但在暴露于100和180 dynes/cm2的剪切应力下5分钟后,分别释放了9.9 ± 6.3 μM和9.8 ± 4.6 μM的ADP(图5B)。此外,将血小板暴露于100 dynes/cm2的剪切应力下,使其对2 μM亚阈值浓度的ADP诱导的聚集更为敏感(图5C)。当红细胞暴露于250 dynes/cm2的剪切应力后被洗涤,再与富血小板血浆(PRP)重建时,它们不再促进SIPA(图5D)。相比之下,预先暴露于剪切应力的血小板与胶原诱导的聚集具有相似的聚集特征(图5E)。我们检测了12名患者在植入Heartmate II型左心室辅助装置(LVAD)患者之前和之后采集的血浆样本。红细胞源性EVs(细胞外囊泡)水平在LVAD植入后显著升高,其作为红细胞破裂和溶血的替代标志物(图5F),表达CD62p的血小板水平以及与vWF结合的血小板源性EVs水平也有所升高。结果表明,病理性高剪切应力会诱导红细胞破裂并释放ADP,从而导致LVAD患者中出现的血小板激活。
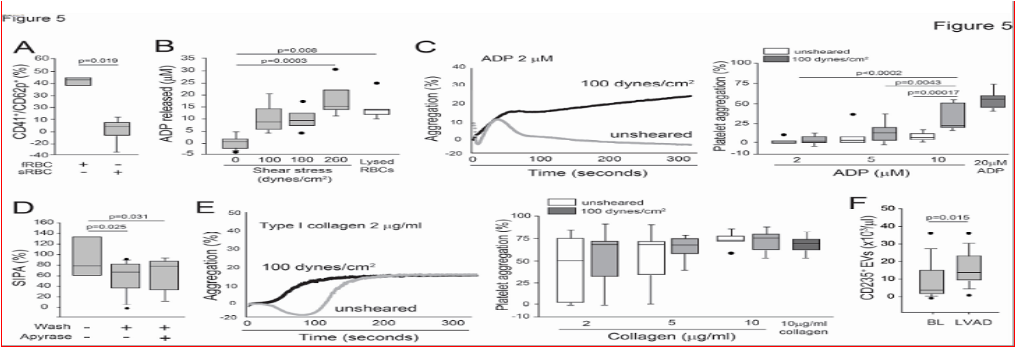
图5、剪切和储存的ADP的协同作用
主要结论:
1、红细胞在不同血小板-红细胞比例下促进止血,涵盖与溶血性贫血、免疫性血小板减少症(ITP)和低增生性全血细胞减少症相关的模型;红细胞以剪切应力依赖的方式在流体相中对血小板反应性有不同的贡献,并在高剪切应力下释放ADP;改变膜的变形性会干扰红细胞对止血的支持;
2、红细胞通过多种机制促进止血,这些机制的作用因血液细胞浓度和剪切应力水平而异。未来需要进一步研究红细胞如何通过与纤维蛋白的相互作用支持止血,以及红细胞是否能够减轻高风险患者的出血,例如接受左心室辅助装置(LVAD)的患者和接受血液系统恶性肿瘤治疗的患者。
文献来源:Debbie Jiang, Katie L Houck , Lydia Murdiyarso ,et al. RBCs regulate platelet function and hemostasis under shear conditions through biophysical and biochemical means. Blood. 2024;144(14):1521-1531. doi: 10.1182/blood.2024023887.
3、 血小板中STING的激活通过增强血小板激活和颗粒分泌加剧败血症血栓形成。
编译:蔡仲仁,叶至顺 审校:伍昌林
研究背景:
脓毒症(Sepsis)是一种由全身性感染引起的系统性炎症反应,常导致多器官功能障碍和高死亡率。脓毒症患者常并发血栓形成和凝血障碍,但目前对这些过程的理解仍不充分。血小板(PLT)在维持凝血系统稳态、先天免疫防御和炎症反应中起重要作用。在脓毒症中,血小板被激活并与其他免疫细胞相互作用,导致血栓形成和炎症反应。STING(Stimulator of Interferon Genes)是一种内质网膜蛋白,作为固有免疫的关键传感器,通过识别胞质DNA触发炎症反应。然而,STING在血小板中的作用及其在脓毒症诱导的血栓形成中的作用尚不清楚。本研究旨在揭示血小板STING是否通过调控颗粒分泌和NETosis加剧脓毒症血栓,并探索靶向STING通路的治疗潜在干预策略。
主要研究结果:
1.血小板STING缺陷可缓解脓毒症诱导的血栓形成
实验设计:通过基因编辑构建血小板特异性STING敲除小鼠(Sting-/-),并与野生型小鼠(Sting+/+)进行盲肠结扎穿孔(CLP)脓毒症模型对比。结果显示:体内成像:通过活体显微镜(IVM)动态观察肝脏和肺血管中的血栓形成,CLP术后24小时Sting+/+小鼠肝脏和肺血管中可见广泛的血小板聚集和血管闭塞,而Sting-/-小鼠的血栓面积显著减少;凝血指标:Sting-/-小鼠外周血小板计数升高,血浆TAT水平下降,纤维蛋白原恢复至接近正常水平;组织病理:Sting-/-小鼠的肝肺组织损伤和血栓面积显著减少(图1)。
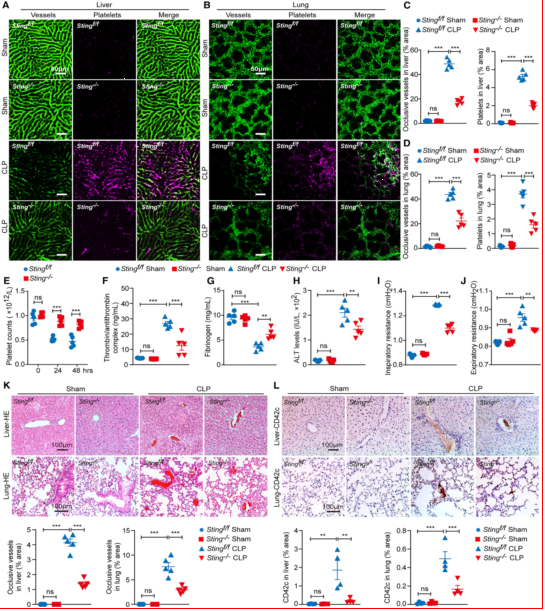
图 1、血小板STING缺乏缓解败血症诱导的血栓形成
2.血小板STING缺陷抑制脓毒症中NET形成
实验设计:通过检测MPO-DNA复合物水平及活体成像技术定量中性粒细胞NETs,并使用P-选择素阻断抗体验证血小板-中性粒细胞相互作用对NETs的影响。研究结果:Sting-/-小鼠的MPO-DNA复合物水平和活体成像显示的NETs数量显著降低,P-选择素抗体可抑制血小板与中性粒细胞的相互作用,进一步减少NETs形成(图2)。
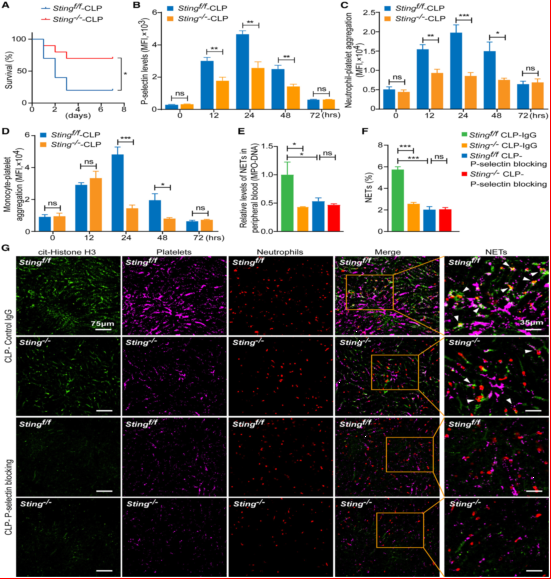
图2、血小板STING缺乏抑制败血症中NET的形成
3.cGAMP通过STING依赖性途径激活血小板
实验设计:用脓毒症血浆或外源性cGAMP刺激血小板,分析活化标志物(P-选择素、整合素αIIbβ3)。cGAMP的促活化效应:脓毒症血浆中cGAMP水平升高,能增强血小板聚集和颗粒分泌,且该效应在Sting-/-血小板中消失;棕榈酰化调控:cGAMP和凝血酶诱导STING棕榈酰化,抑制剂H151可阻断此过程并抑制血小板活化(图3)。
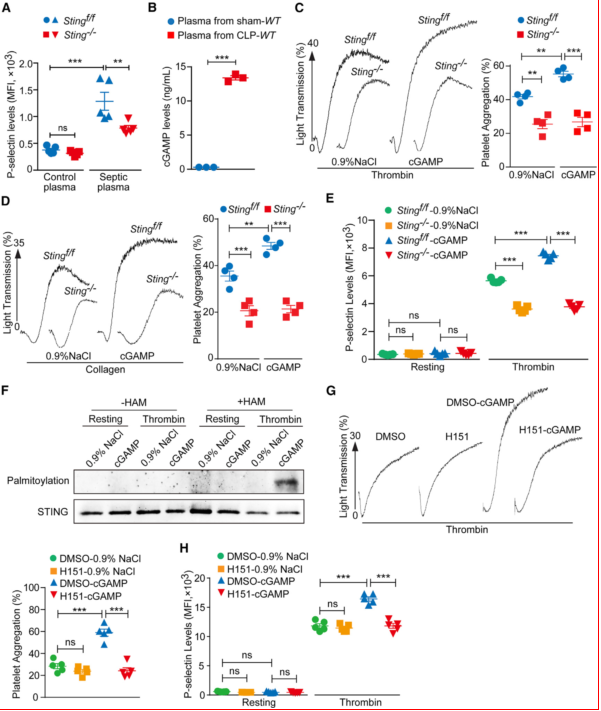
图3、cGAMP以刺激依赖的方式促进血小板活化
4.STING通过SNARE复合体调控血小板颗粒分泌
实验设计:通过免疫共沉淀(IP)与质谱鉴定STING相互作用蛋白,以及SNARE复合体分析。STING与STXBP2的直接结合:IP-MS显示STING与STXBP2在静息血小板中存在物理结合;SNARE复合体组装:STING与STXBP2结合,促进Syntaxin11、VAMP8和SNAP23的SNARE复合体形成。颗粒分泌缺陷:Sting-/-血小板的α颗粒(PF4)、致密颗粒(ATP)和溶酶体(LAMP1)分泌减少透射电镜(TEM)显示Sting-/-血小板颗粒数量正常,但分泌受阻(图4)。
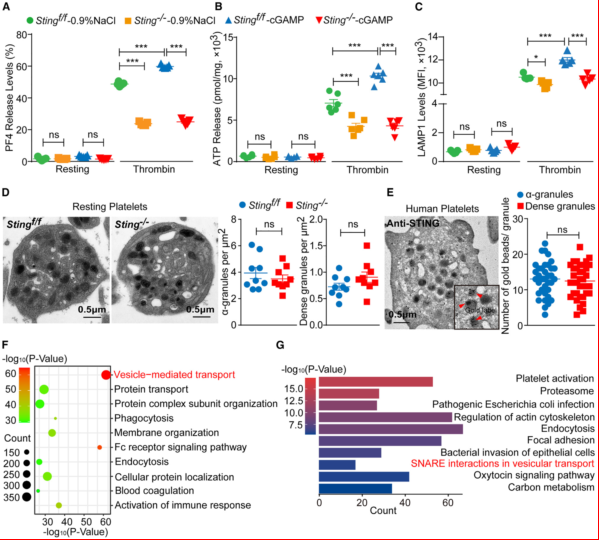
图4、STING促进血小板颗粒分泌
5. C-ST5肽抑制STING-STXBP2结合并减轻血栓形成
实验设计:设计靶向STING-STXBP2结合域的肽C-ST5,并在体外和CLP模型中验证其效果。体外抑制:C-ST5显著抑制血小板聚集和P-选择素暴露;NETs抑制:C-ST5处理的血小板与中性粒细胞共培养时,C-ST5减少血小板诱导的中性粒细胞NETs形成;体内疗效:CLP小鼠接受C-ST5治疗后,血栓形成减少,凝血指标改善,生存率提高(图5)。
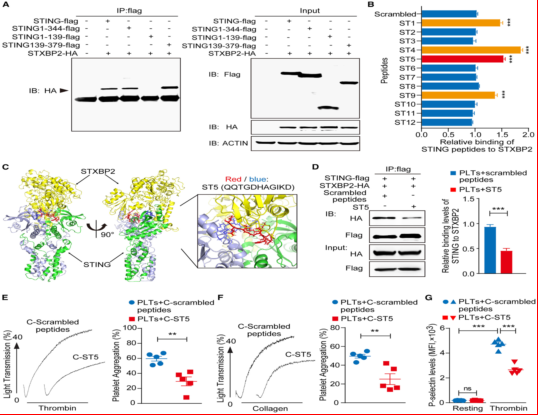
图5、肽ST5抑制STING与STXBP2的结合和血小板活化
主要结论:
1、STING是脓毒症血栓形成的关键调控因子:血小板STING通过促进颗粒分泌和P-选择素暴露,驱动血小板-中性粒细胞互作及NETosis,最终导致微血管血栓和多器官损伤。
2、cGAMP-STING-STXBP2轴的核心机制:脓毒症中病原体或损伤释放的DNA激活cGAS,生成cGAMP并激活血小板STING。STING的棕榈酰化修饰增强其与STXBP2的结合,进而促进SNARE复合体组装和颗粒分泌。
3、治疗潜力:靶向STING-STXBP2相互作用的多肽C-ST5可有效抑制血小板活化和血栓形成,为脓毒症抗凝治疗提供了新策略。
文献来源:Mina Yang, Haojie Jiang, Chen Ding,et al. STING activation in platelets aggravates septic thrombosis by enhancing platelet activation and granule secretion. Immunity. 2023;56(5):1013-1026.e6. doi: 10.1016/j.immuni.2023.02.015.
全文审校:李志强 潘 健